Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista de Ciencias
Print version ISSN 0121-1935
rev. cienc. vol.18 no.2 Cali July/Dec. 2014
Use of Samanea saman and Pithecellobium dulce (Fabaceae: Mimosoideae) by Birds in the University Botanical Garden, Cali, Colombia
Uso de Samanea saman y Pithecellobium dulce (Fabaceae: Mimosoideae) por aves en el Jardín Botánico Universitario, Cali, Colombia
Alba Marina Torres González
Departamento de Biología, Universidad del Valle, Cali - Colombia
E-mail: alba.torres@correounivalle.edu.co
Jhon Alexander Vargas Figueroa
Departamento de Biología, Universidad del Valle, Cali - Colombia
E-mail: lexvafi13@gmail.com
Leonardo Guevara Ibarra
Departamento de Biología, Universidad del Valle, Cali - Colombia
E-mail: leonardo.guevara@correounivalle.edu.co
Martín Llano Almario
Departamento de Biología, Universidad del Valle, Cali - Colombia
E-mail: martin.llano.a@hotmail.com
Jorge A. Orrego Pineda
Departamento de Biología, Universidad del Valle, Cali - Colombia
E-mail: jorgeorregaceae@gmail.com
Olga Lucía Duque Palacio
Departamento de Biología, Universidad del Valle, Cali - Colombia
E-mail: olgadu64@yahoo.es
María Paula Moreno Cavazos
Departamento de Biología, Universidad del Valle, Cali - Colombia
E-mail: ma.paulamoreno90@gmail.com
Jorge Mario Ruiz Idarraga
Departamento de Biología, Universidad del Valle, Cali - Colombia
E-mail: jorge.ruiz.i@correounivalle.edu.co
Received: November 7, 2014
Accepted: December 19, 2014
Abstract
The wooded areas of cities, such as the campus of Melendez at the Universidad del Valle, have the importance of connecting urban and rural areas and providing resources for sustaining biodiversity in the city. The objective of this research was to determine the use of saman tree (Samanea saman) and chiminango tree (Pithecellobium dulce) by birds, in the University Botanical Garden (UBG) of the Universidad del Valle, Cali, Colombia. The saman and chiminango were visited by 45 species of birds of 17 families, among them one endemic, 41 resident and 3 migratory, between September and November, 2012. The hummingbird Ocreatus underwoodii was first recorded for the UBG. Feeding was the most important activity for birds and was distributed for each tree species as follow: nectar consumption (51.4%) and search-consumption of insects (47.1%) in saman, and search-consumption of insects (61.5%) and seed consumption (29.7%) in chiminango. There were folivory and flower predation registered by certain species of birds in chiminango and saman, and chicks searchinghunting in saman. In addition, four species of birds constructed nests in chiminango, while any in saman. In conclusion, the birds used the substrates and layers of trees, so they coexist and utilize the tree resources. In fact, the bird species that most frequently visited saman and chiminango, used all layers and had a diet varied or generalist.
Keywords: saman, chiminango, tree layers, tree substrates, activities of birds.
Resumen
Las áreas boscosas de las ciudades, como el campus Meléndez de la Universidad del Valle, tienen la importancia de conectar el área urbana y el área rural y ofrecer recursos para el sostenimiento de la biodiversidad en la ciudad. El objetivo de esta investigación fue determinar el uso de los árboles samán (Samanea saman) y chiminango (Pithecellobium dulce) por aves, en el Jardín Botánico Universitario (JBU) de la Universidad del Valle, Cali, Colombia. El samán y el chiminango fueron visitados por 45 especies de aves de 17 familias, una endémica, 41 residentes y 3 migratorias, entre septiembre y noviembre de 2012. Se registró por primera vez para el JBU el colibríOcreatus underwoodii. La alimentación fue la actividad más importante de las aves y se distribuyó en cadaespecie de árbol así: consumo de néctar (51.4%) y búsqueda-consumo de insectos (47.1%) en samán; y búsqueda-consumo de insectos (61.5%) y consumo de semillas (29.7%) en chiminango. Hubo folivoría y depredación de flores por algunas especies de aves en samán y chiminango, y acechocaza de polluelos en samán. Además, cuatro especies de aves construyeron nido en el chiminango, mientras que ninguna lo hizo en samán. En conclusión, las aves usaron los sustratos y estratos, de manera que ellas coexisten y utilizan los recursos que los árboles proveen. De hecho, las especies de aves que visitaron más frecuentemente el samán y chiminango, utilizaron todos los estratos y tuvieron una dieta heterogénea o generalista.
Palabras clave: samán, chiminango, estratos del árbol, sustratos del árbol, actividades de las aves.
1. Introducción
El uso de los árboles tropicales por parte de la comunidad de aves ha sido estudiado principalmente por la oferta de frutos (Kantak, 1979; Graham et al., 2002) y por el recurso ofrecido por las epífitas que éstos albergan (Nadkarni & Matelson, 1989). Además, los recursos asociados que provee la vegetación de los bosques, inciden en una mayor densidad reproductiva de las aves (Mills et al., 1991). Por otro lado, los árboles remanentes de bosque que quedan aislados en pasturas de paisajes transformados, son sitios naturales donde las aves frugívoras se posan (Guevara et al., 1986). Estos árboles producen lluvia de semillas, y contribuyen a mantener la diversidad de la vegetación y a conectar fragmentos de bosque (Galindo-González et al., 2000). Las aves juegan una función muy importante en la polinización y dispersión de las especies vegetales. La dispersión entendida como la liberación de semillas o frutos desde la planta madre (Howe & Smallwood, 1982), es un proceso muy importante que afecta la distribución y viabilidad a largo plazo de las poblaciones vegetales (Harper, 1977). La dispersión tiene varios beneficios, como la reducción en los niveles de depredación de propágulos, favorece la germinación de semillas y la colonización de nuevos hábitats (Sanchez-Cordero & Martinez-Gallardo,1998; Asquith, 1999).
El paisaje transformado del valle geográfico del río Cauca y gran parte del municipio de Cali, pertenecen al ecosistema de bosque seco tropical (Espinal & Montenegro, 1963), considerado el más amenazado de las zonas bajas del trópico (Janzen, 1988). Para Colombia, en la cuenca alta del río Cauca, en este ecosistema solo se encuentran pequeños remanentes aislados que representan el 1,8% de cobertura vegetal actual (Arcila-Cardona, 2012). Los fragmentos de bosque y áreas boscosas, como el campus Meléndez de la Universidad del Valle, se convierten en puntos de conexión entre el área urbana y el área rural para la vida silvestre, ofreciendo recursos importantes para el sostenimiento de la biodiversidad en la ciudad. Sin embargo, el manejo de la vida silvestre en áreas urbanas y suburbanas ha sido ignorado por décadas (DeStefano & DeGraaf, 2003). Cada vez son más las áreas boscosas que son convertidas en campos de cultivos o en áreas urbanas, por lo que estos sitios deben ser vistos como nuevos hábitats para la protección de la fauna y la flora de la región, ya que ofrecen recursos alimenticios que son explotados por éstos, aumentando su densidad en estos sitios (Shochat, 2010b).
El objetivo de este estudio fue responder la incógnita de: qué uso hacen las aves de los árboles samán (Samanea saman (Jacq.) Merr.) y chiminango (Pithecellobium dulce (Roxb.) Benth.) en un hábitat urbano de la ciudad de Cali, Colombia. Para ello se buscó establecer las actividades alimentarias, reproductivas o de reposo que las aves realizan en los diferentes sustratos y estratos de cada especie de árbol, para identificar los recursos que proporcionan estas especies de árboles a la diversidad de aves en el Jardín Botánico Universitario de la Universidad del Valle, Cali, Colombia.
2. Materiales y métodos
Localidad
El estudio se realizó en el Jardín Botánico Universitario, ubicado en el campus de la Universidad del Valle, sede Meléndez, Cali, Colombia, a 995 m de altitud, 3º27' Norte y 76º32' Oeste. La ciudad de Cali presenta una temperatura media de 25 ºC, precipitación anual de 908 mm, humedad relativa del 73 %, con dos períodos anuales de lluvia; uno que comprende los meses de marzo, abril y mayo, y otro al final del año en los meses de septiembre, octubre y noviembre (Aerocali, 2010).
El campus de la Universidad del Valle tiene una gran diversidad de especies de plantas (Herrera, 2009) y aves (Reyes-Gutierrez et al., 2002), y ha sido declarado recientemente Jardín Botánico Universitario (Acuerdo 004 de 2010 de la Universidad del Valle). El campus tiene cercanía y cierta conectividad con bosques suburbanos y se ha convertido en área boscosa, con más de 4700 árboles con DAP ≥ 10 cm (Torres et al. datos no publ.).
2.2. Especies de árboles
El samán es originario de América tropical, se usa principalmente para sombrío y regeneración de zonas secas degradadas (Gentry, 1993; Tokura et al., 1996; Wishnie et al., 2007). El samán es un árbol que puede alcanzar hasta 40 m de altura, con una copa semiesférica, flores dispuestas en inflorescencias capituliformes, con filamentos largos, rosados y blancos; el fruto es una legumbre indehiscente (Rico, 2001). Por otro lado, el chiminango tiene origen en Centro América, es utilizado en la recuperación de suelos parcialmente degradados por su crecimiento rápido y su capacidad de fijar nitrógeno al suelo (Mabberley, 1997; Tokura et al., 1996). El chiminango es un árbol mediano con tallos retorcidos, inflorescencias terminales y axilares con flores blancas, frutos en legumbres dehiscentes con semillas negras cubiertas por un arilo blanco (Méndez y Calle, 2007). Este árbol alberga abundantes epífitas del género Tillandsia (Pérez-Arbeláez, 1990). Estas especies son comunes en potreros y sistemas silvopastoriles, donde proporcionan sombra, forraje y frutos para el ganado (Méndez y Calle, 2007; Velásquez-Vélez et al., 2009; Nilsen et al., 2009).
El samán y el chiminango están entre las especies más comunes del Jardín Botánico Universitario (Torres et al. datos no publ.). Se seleccionaron tres árboles de chiminango y tres de samán, en estado reproductivo, con alta floración y fructificación. Cuando terminó la floración y fructificación de los tres árboles de chiminango, la observación se realizó en otros tres árboles cercanos y de tamaño similar que estuvieron en floración y fructificación. Los árboles fueron medidos con un clinómetro electrónico HEC marca Haglöf y un decámetro. La altura promedio de los árboles de chiminango fue 13.7 m y el diámetro a la altura del pecho (DAP) promedio fue 43.34 cm. Por otra parte, la altura promedio de los árboles de samán fue 14.7 m y el DAP promedio fue 98.10 cm. La distancia entre los árboles se midió con un GPS Garmin. Los árboles de chiminango estuvieron separados entre sí por 22 m y los de samán por ca. 285 m. Cada árbol de cada especie se dividió espacialmente en tres sustratos: tronco (i.e tallo leñoso principal no ramificado), ramas (i.e tallos leñosos secundarios) y hojas (i.e. tallos terminales con hojas y rebrotes). Además, cada árbol se dividió en tres estratos: estrato bajo (ca. 0-3,5 m), estrato medio (ca. 3,5-8,5 m) y estrato alto (ca. 8,5-14,5 m).
2.3. Muestreo de aves
El estudio se realizó entre el 12 septiembre y 8 noviembre 2012. En septiembre se registró una temporada seca, mientras que en octubre y noviembre aumentó la precipitación; la temperatura promedio fue 23.5 °C (Cárdenas et al. datos no publ.). Las observaciones de aves fueron realizadas un día por semana, entre las 6:00 y las 9:00 h. Se observaron semanalmente tres arboles por especie, en cada uno de los cuales se ubicó un observador con binoculares Nikon 8x42. Las especies de aves se identificaron con las guías de campo de Hilty & Brown (2009) y McMullan et al. (2011). Se siguió la nomenclatura de la lista de aves de Suramérica de la AOU (American Ornithologists' Union) (2014). La observación se dirigió a registrar cada individuo de ave que llegó a cada árbol, la duración de la estadía en el árbol (en minutos) y a identificar el estrato y sustrato del árbol. Además, se identificó la actividad que realizó cada individuo de ave por visita, a saber: 1) alimentación, 2) descanso/ percha y 3) reproducción. A su vez, la actividad de alimentación se dividió en los tipos a) consumo de semillas, b) de flores, c) de néctar, d) de hojas y e) caza/acecho de polluelos.
2.4. Análisis estadístico
La observación de cada individuo de ave se constituyó en un registro que fue anotado, codificado y analizado de manera independiente para cada especie de árbol. Se hizo un análisis de frecuencia de registros, expresados en porcentaje (%), un análisis de grupos utilizando la presencia o ausencia de cada individuo de ave en los diferentes sustratos, estratos de cada árbol y la actividad registrada, usando el algoritmo ligamiento de Ward's y distancias de ligamiento 1-Pearson r. Estos análisis se realizaron con el paquete estadístico Statistica versión 7 (Statsoft, 2004). Además, se realizó un análisis de Friedman con corrección de Bonferroni para muestras no paramétricas repetidas, con el fin de comparar la frecuencia de registros en los sustratos, estratos, las actividades y los tipos de alimentación registradas. Para ello, se utilizó el paquete estadístico PAST versión 2.17 (Hammer, 2001).
3. Resultados
3.1. Uso del chiminango
Se registraron 29 especies de aves, pertenecientes a 14 familias, de las cuales ocho especies fueron observadas solamente en esta especie de árbol (Tabla 1). La mayoría de aves fueron registradas por períodos de tiempo mayor o igual a 10 minutos (41%). Las especies que tuvieron mayor número de registros y usaron el árbol por mayor tiempo fueron Thraupis episcopus, Columbina talpacoti, Zenaida auriculata, Tyrannus melancholicus, y la especie migratoria Setophaga petechia.
Tabla 1. Frecuencia de actividades de las especies de aves que usan el samán (Samanea saman) y el chiminango (Pithecellobium dulce) en el Jardín Botánico Universitario, Cali, Colombia. (M: especie migratoria; END: especie endémica; CA: consumo alimentario; A: alimentación; R: reproducción; D: descanso)
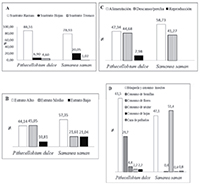
El sustrato del árbol en el que hubo más registros de aves fue ramas (88.51%, p<0.05), (Figura 1a). La especie T. episcopus fue la única que usó los tres sustratos. Los registros de uso de los estratos muestran que los más usados fueron el estrato medio (45.05%, p<0.05) y el estrato alto (45.14%, p<0.05), (Figura 1b). Las especies T. episcopus, T. melancholicus, Pyrocephalus rubinus y C. talpacoti usaron los tres estratos. Se registró la especie endémica Picumnus granadensis en ramas del estrato medio.
Figura 1. Frecuencia del uso de los árboles chiminango (Pithecellobium dulce) y samán (Samanea saman por aves en el Jardín Botánico Universitario, Cali, Colombia. a) uso de los sustratos, b) uso de los estratos, c) actividades de las aves, d) actividades alimentarias de las aves
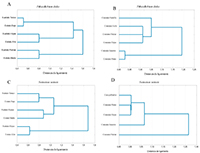
Las especies de aves que visitaron el chiminango hicieron una distribución espacial en el uso del árbol, de manera que un grupo de especies de aves usó el sustrato tronco y el estrato bajo, otro grupo usó el sustrato ramas y el estrato medio, y otro el sustrato hojas y el estrato alto (Figura 2a).
Figura 2. Agrupamiento del uso de los árboles chiminango (Pithecellobium dulce) y samán (Samanea saman) por aves en el Jardín Botánico Universitario, Cali, Colombia. a) sustratos y estratos de chiminango, b) sustratos y estratos de samán, c) actividad alimentaria en chiminango, d) actividad alimentaria en samán
Las actividades de las aves registradas en el chiminango fueron alimentación (47.34%), reposo (44.68%) y reproducción (7.98%), (Figura 1c). La búsqueda y consumo de insectos fue la actividad alimentaria más importante para las aves (61.5%, p<0.05), después consumo de semillas (29.7%), consumo de flores (4.4%), consumo de néctar (2.2%) y consumo de hojas (2.2%), (Figura 1d).
Se registraron siete especies de aves consumiendo las semillas de chiminango con arilo, las cuales fueron: T. melancholicus, T. episcopus, Pitangus sulphuratus, Tangara vitriolina, Elaenia flavogaster, Myiozetetes cayanensis, y Saltator striatipectus. Las especies que se registraron comiendo arilo sin semilla fueron T. vitriolina y Z. auriculata. Ningún ave consumió semillas sin arilo. Por otra parte, las especies que tuvieron el mayor registro de búsqueda y consumo de insectos fueron: S. petechia, T. episcopus y T. melancholicus. Estas tres especies también fueron las únicas observadas consumiendo flores de chiminango. Las especies que fueron registradas consumiendo néctar fueron Coereba flaveola y Anthracotorax nigricollis. Aquellas que consumieron hojas fueron T. vitriolina y aparentemente Todirostrum cinereum.
Los recursos que ofrece el chiminango fueron distribuidos entre los gremios de aves, donde un grupo de aves, claramente separado, buscó y consumió insectos y/o consumió flores, y otro grupo consumió semillas con arilo, arilo solo, follaje y/o néctar (Figura 2c).
Cuatro especies de aves se registraron construyendo nidos en el chiminango, las cuales fueron: T. episcopus, M. cayenensis, T. melancholicus y C. flaveola. Las dos primeras especies fueron observadas ocupando el nido.
3.2. Uso del samán
Se registraron 37 especies de aves pertenecientes a 15 familias, de las cuales 15 especies fueron exclusivas para esta especie de árbol (Tabla 1). El mayor número de registros de aves correspondió a visitas cortas, igual o menor a tres minutos (73%). Las especies que tuvieron mayor número de registros y que estuvieron más tiempo asociadas al samán fueron: C. flaveola, P. rubinus, Chlorostilbon melanorhynchus, T. episcopus y S. petechia. Se registró también la especie endémica P. granadensis en ramas del estrato alto, realizando búsqueda y consumo de insectos.
El sustrato ramas fue el que tuvo un mayor registro de uso (78.93%, p<0.05), (Figura 1a), especialmente por C. flaveola, P. rubinus y C. melanorhynchus. El sustrato hojas tuvo un registro intermedio (20.05%) y fue usado principalmente por S. petechia. El sustrato tronco fue el menos usado, registrándose dos eventos de uso por parte de Lepidocolaptes souleyetii.
El estrato alto fue el más usado por las aves (57.35%, p<0.05), registrándose principalmente las especies C. flaveola y C. melanorhynchus, seguido de los estratos medio (21.61%) y bajo (21.04%), (Figura 1b), en los cuales se registraron mayormente C. flaveola y P. rubinus, respectivamente. Sin embargo, 11 especies de aves usaron los tres estratos.
La distribución del uso de los sustratos y estratos por las aves fue bien definida por las especies que visitaron el samán. Un grupo usó el sustrato tronco y el estrato bajo, otro grupo usó el sustrato ramas y el estrato medio, y otro grupo usó el sustrato hojas y el estrato alto (Figura 2b).
Por otro lado, las actividades registradas en el samán fueron alimentación (57.73%) y reposo (41.27%), (Figura 1c). No hubo registro de actividades reproductivas de ninguna especie de ave. La actividad alimentaria fue principalmente consumo de néctar (51,4%), seguida de búsqueda o consumo de insectos (47,1%), acecho y caza de polluelos (0.8%), consumo de hojas (0,4%) y flores (0.4%), (Figura 1d). Se registró picoteo de frutos por parte de T. episcopus, S. striatipectus y T. vitriolina, pero ningún evento resultó en apertura o consumo del fruto, ni consumo de semillas. La especie que tuvo el mayor registro de búsqueda y captura de insectos fue P. rubinus, seguida de S. petechia y T. episcopus. Siete especies se registraron consumiendo néctar, las cuales fueron: C. flaveola y los colibríes A. nigricollis, Amazilia saucerottei, A. tzacatl, C. melanorhynchus, Ocreatus underwoodii y Florisuga mellivora. La especie que consumió flores fue T. episcopus y la que consumió hojas fue Hemithraupis guira.
Los gremios de aves se distribuyeron los recursos ofrecidos por el samán. Un grupo de aves consumió néctar, otro grupo de especies buscó y consumió insectos, y otro grupo realizó acecho y caza de polluelos, consumo de flores y/o follaje (Figura 2d).
4. Discusión
El chiminango y el samán ofrecen albergue para una riqueza muy alta de aves en el Jardín Botánico Universitario, con el registro de cerca del 25% (45 de 166 especies) de las especies reportadas para el campus de la Universidad del Valle (Reyes-Gutierrez, 2002; Muñoz, 2007). Estos datos sugieren que estas dos especies de árboles son ciertamente importantes para la comunidad de aves, en términos de los servicios que les ofrecen a las especies de aves observadas, como: alimentación, refugio y lugar de anidación. Se registra por primera vez para el Jardín Botánico Universitario y para el municipio de Cali el colibrí O. underwoodii (i.e. en samán, oct 2012). Es conocido que O. underwoodii realiza migraciones a bajas altitudes y busca flores de Inga spp. y especies similares en el dosel del bosque (Hilty & Brown, 2009) Este nuevo registro indica que existe conexión exitosa para aves con dieta más específica como O. underwoodii, entre el campus de la Universidad del Valle, las zonas rurales y los bosques cercanos de la zona suburbana y sitios de mayor altitud, a través de las especies vegetales existentes. Además, se confirma la ampliación de la distribución del carpintero (Melanerpes rubricapillus) en el valle geográfico del río Cauca. Esta especie tradicionalmente se ha registrado en zonas de la cordillera occidental y central, en el valle del río Magdalena, los Santanderes y zonas de la costa caribe colombiana (Hilty & Brown, 2009) , y actualmente está colonizando el valle geográfico del río Cauca (Garcés-Restrepo et al., 2012). Adicionalmente, el uso registrado por las aves del S. saman y P. dulce, que son especies propias de los bosques secos tropicales de América, apoya la idea de que la existencia de especies nativas en un área urbana es crítica para el sostenimiento de ciertas poblaciones de aves (Mills et al., 1989). Además, se ha encontrado que el tipo de vegetación de un sitio urbano influye en la comunidad de aves (Beissinger & Osborne, 1982), ya que dependiendo de los recursos ofrecidos por una especie arbórea plantada, así serán los gremios de aves que se vean favorecidos y dominen en el sitio.
La distribución del uso de los estratos por las aves en árboles aislados de samán y chiminango, puede ser un mecanismo de coexistencia y distribución de los recursos. Esta distribución es similar a la distribución del ensamble de aves en las diferentes alturas de los bosques tropicales y septentrionales (Pearson, 1971; Bell, 1982; López, 2001). De hecho, existe un uso general de los tres estratos por parte de las especies más comunes (i.e. T. episcopus, T. melancholicus,C. talpacoti en chiminango, y C. flaveola, P. rubinus, T. episcopus, S. petechia en samán). Esto es contrario a lo que ocurre con la partición temporal en el uso de los recursos ofrecidos en los hábitats urbanos por la comunidad de aves, donde las aves especialistas en forrajeo eficiente dominan los sitios y pueden llegar a excluir completamente a las aves generalistas de forrajeo ineficiente (Shochat et al., 2004; Shochat et al., 2010). En contraste, en hábitats naturales y paisajes parcialmente transformados suele ocurrir que las aves especialistas son subordinadas por las aves generalistas, ya que dependen del tiempo en el que estas últimas usan el recurso, del que ellas disponen posteriormente (Ziv et al., 1993; Winfree et al., 2011).
En las dos especies de árboles, el sustrato ramas fue el más usado por las aves, el cual se encuentra precisamente en los estratos más usados para ambas especies. Debido a que la alimentación fue la actividad más importante de las aves en las dos especies de árboles, la alta frecuencia de uso de los sustratos y estratos se explica por la ubicación del recurso que estos ofrecen. En samán, las inflorescencias se ubican en la parte más alta del árbol, lo cual coincide con una mayor actividad alimentaria en esta especie, por siete especies de aves nectarívoras. Además, la elevada actividad de este gremio responde al estado fenológico de floración del árbol, cuyas inflorescencias funcionan como una unidad de atracción para las aves y presentan flores dimórficas. Entre los dos tipos de flores, se ha reportado producción de néctar en la flor central, mientras que las flores periféricas no presentan una recompensa aparente para las aves (Haber & Frankie, 1989).
Por otro lado, la alta búsqueda y consumo de insectos registrada para el samán y chiminango, es consistente con el reporte alto de aves insectívoras en el campus de la Universidad del Valle (Reyes-Gutierrez, 2002; Muñoz et al., 2007). De hecho, este es el gremio que registra una mayor riqueza de especies en zonas rurales de Cali y otros sitios del Valle del Cauca (Naranjo, 1992; Naranjo y Estela, 1999; Orejuela, 1979; Orejuela et al., 1979; Rivera-Gutiérrez, 2006). Esto sugiere que el samán y el chiminango ofrecen un hábitat adecuado para los ensambles de insectos, los cuales son muy importantes para las relaciones que se establecen en las comunidades bióticas y sus procesos naturales (Méndez, 2008), y además, son importantes en la dieta de las aves (Morton, 1973).
El arilo de las semillas de chiminango es un gran atractivo para las aves. La mayoría de registros de consumo correspondió a semillas con arilo, siendo estas aves posibles dispersoras de esta especie. No obstante, hubo folivoría y depredación de botones florales y flores por algunas especies de aves en la mayoría de las jornadas de muestreo, lo cual puede disminuir la producción de frutos de chiminango. Este comportamiento suele ocurrir en ciertas especies de aves en épocas donde abundan diferentes fuentes de recursos. Por ejemplo, en época lluviosa se ha registrado que especies de Leptotila, Saltator y Myiozetetes aumentan el consumo de insectos, mientras que P. sulphuratus disminuye el consumo de estos organismos (Herrera et al., 2006), lo que sugiere que la proteína adquirida por el ave puede ser mayormente de origen vegetal en esta época. Sin embargo, el registro de Todirostrum cinereum consumiendo hojas es dudoso y pudo ser más bien una forma de atrapar insectos incluyendo la hoja dentro del pico. El chiminango y el samán también ofrecen lugar para el reposo frecuente de las aves, esto debido a su arquitectura de múltiples ramas de diferente diámetro. Sin embargo, el chiminango fue un recurso importante para la reproducción de cuatro especies de aves, las cuales construyeron y ocuparon nidos durante el período de estudio. Esto sugiere que hay una cantidad de recursos asociados a la vegetación que favorecen la reproducción de las aves (Mills et al., 1991), ya que éstas suelen seleccionar sitios que presentan mayor cobertura vegetal, mayor número de troncos y menor número de ramas muertas o desnudas (Kelly, 1993). En contraste, la ausencia de actividad reproductiva en el samán puede explicarse porque en los árboles desnudos sin epífitas, hay menor sobrevivencia de nidos, como ocurre en el anidamiento de palomas (Rivera-Milán, 1996). Además, es conocido que las aves después de eventos de depredación, cambian el lugar de anidación (Martin, 1992), lo que sugiere que el samán puede no ser un sitio ideal para la reproducción de las poblaciones de aves del campus. De hecho, solamente en samán se registraron aves depredadoras (e.g. B. magnirostris y M. chimachima). Lo anterior puede indicar que la protección del nido es un factor que incide en la preferencia del sitio de anidación, como se registran en estudios con diferentes especies de aves (e.g. Alonso et al., 1991; Morton et al., 1993), lo que le otorga a P. dulce cierta importancia en el sostenimiento de las poblaciones de aves. No obstante, esta no es una regla general y depende precisamente de la especie de ave y de los factores incidentes (Mezquida, 2004; Córdoba-Córdoba et al., 2010).
El casi nulo registro de interacción entre las aves y los frutos de samán, muestra el poco atractivo que estos representan para éstas. Los registros de consumo de frutos de samán han sido por diferentes mamíferos, algunos de los cuales pueden llegar a ser dispersores (Janzen, 1982b; Janzen & Martin, 1982; Vaughan et al., 2007), incluso en sitios donde ha sido introducido (Prasad & Sharatchandra, 1984). Además, se ha encontrado que la ingesta de semillas por parte del ganado tiende a aumentar la germinación (Jolaosho et al., 2006). En Costa Rica, se observó un grupo de loras no identificadas alimentándose de los frutos de samán (Janzen, 1982a); no obstante, estas aves ingirieron el contenido de las semillas y descartaron la testa, siendo depredadoras y no dispersoras de semillas.
5. Conclusiones
El samán y el chiminango ofrecen una variedad de recursos para las aves residentes y migratorias del Jardín Botánico Universitario, principalmente alimenticios, siendo fuente de néctar, semillas, flores, hojas e insectos. La arquitectura de los árboles ofrece lugares de percha y reposo para las aves, y son fuente de material y lugar de anidación. Las especies de aves registradas consumiendo semillas de P. dulce son dispersoras potenciales de esta especie en el Jardín Botánico Universitario, mientras que la dispersión en S. saman no se lleva a cabo por aves en este sitio. Los grupos de aves usan los sustratos y estratos, de manera que coexisten y utilizan los recursos que los árboles proveen. De hecho, las especies de aves que visitan con más frecuencia los árboles de samán y chiminango, utilizan todos los estratos y tienen una dieta heterogénea o generalista.
Agradecimientos
Los autores expresan su agradecimiento a la Universidad del Valle por la financiación de esta investigación a través de la Vicerrectoría de Investigaciones, y a las Biólogas Ãngela Jiménez, Katherine Rivera y Viviana Londoño, integrantes del grupo de investigación "Ecología y Diversidad Vegetal", por su colaboración con las observaciones.
Referencias
Aerocali. (2010). Sociedad Concesionaría del Aeropuerto Internacional Alfonso Bonilla Aragón. Recuperado 11/05/2010 http://www.aerocali.com.co [ Links ]
Alonso, J.A., Muñoz-Pulido, R., & Bautista, L.M. (1991). Nest-site selection and nesting success in the Azure-winged Magpie in Central Spain. Bird Study, 38, 45-51. [ Links ]
American Ornithologists' Union. (2014). A Classification of the Bird Species of South America. South American Classification Committee. Recuperado 26/03/2014 http://www.museum.lsu.edu/~Remsen/SACCRecentChanges.htm [ Links ]
Arcila Cardona, A.M., Valderrama Ardila, C., Ulloa, D., & Chacón, P. (2012). Estado de fragmentación del bosque seco de la cuenca alta del río Cauca, Colombia. Biota Colombiana, 13 (2), 86-102. [ Links ]
Asquith, N., Terborgh, J., Arnold, E., & Riveros, M. (1999). The fruits the agouti ate: Hymenaea courbaril seed fate when its disperser is absent. Journal of Tropical Ecology, 15, 229-235. [ Links ]
Beissinger, S., & Osborne, D. (1982). Effects of urbanization on avian community organization. The Condor, 84, 75-83. [ Links ]
Bell, H. (1982). A bird community of New Guinean lowland rainforest. 3. Vertical distribution of the avifauna. Emu, 82, 143-162. [ Links ]
Córdoba-Córdoba, S., Ouyang, J.Q., & Hauck, S.J. (2010). Nesting preferences and population estimates of a new black noddy anous minutus breeding colony on one tree island. Marine Ornithology, 38, 79-84. [ Links ]
DeStefano, S., & DeGraaf, R. (2003). Exploring the ecology of suburban wildlife. Ecological Society of America, 1(2), 95-101. [ Links ]
Espinal, L.S., y Montenegro, E. (1963). Formaciones vegetales de Colombia. Bogotá, Colombia: Instituto Geográfico "Agustín Codazzi". Departamento Agrológico (pp. 201). [ Links ]
Galindo-González, J., Guevara, S., & Sosa, V.J. (2000). Bat- and bird-generated seed rains at isolated trees in pastures in a tropical rainforest. Conservation Biology, 14, 1693-1703. [ Links ]
Garcés-Restrepo, M.F., Saavedra-Rodríguez, C.A., Cárdenas-Carmona, G., Vidal- Astudillo, V., Ayerbe-Quiñones, F., Ortega, L.F. (2012). Expansión de la distribución y datos ecológicos del Carpintero Habado (Melanerpes rubricapillus) en el valle del río Cauca, Colombia. Ornitología Colombiana, 12, 54-60. [ Links ]
Gentry, A. (1993). A field guide to the families and genera of woody plants of northwest South America. Washington D.C., USA: Conservation International. [ Links ]
Graham, C., Martinez-Leyva, J., & Cruz-Paredes, L. (2002). Use of fruiting trees by birds in continuous forest and riparian forest remnants in Los Tuxtlas, Veracruz, Mexico. Biotropica, 34, 589-597. [ Links ]
Guevara, S., Purata, S., & Van der Maarel, E. (1986). The role of remnant forest trees in tropical secondary succession. Vegetatio, 66, 77-84. [ Links ]
Haber, W.A., & Frankie, G.W. (1989). A tropical hawkmoth community: Costa Rican dry forest Sphingidae. Biotropica, 21, 155-172. [ Links ]
Hammer, Ø., Harper, D. A. T., & Ryan, P. D. (2001). PAST: Paleontological Statistics Software Package for Education and Data Analysis. Palaeontologia Electronica, 41(1). Recuperado http://palaeo-electronica.org/2001_1/past/issue1_01.htm [ Links ]
Harper, J. (1977). Population biology of plants. London, UK: Academic Press. (pp. 892). [ Links ]
Herrera, L.G., Hobson, K.A., Martínez, J.C., & Méndez, G. (2006). Tracing the origin of dietary protein in tropical dry forest birds. Biotropica, 36, 735-742. [ Links ]
Herrera, S. (2009). Árboles de la Universidad del Valle. Cali, Colombia: Programa Editorial Universidad del Valle. [ Links ]
Hilty, S.L., & Brown, W.H. (2009). Guía de las Aves de Colombia. Bogotá, Colombia: Asociación Colombiana de Ornitologia, ACO. [ Links ]
Howe, H., & Smallwood, J. (1982). Ecology of seed dispersal. Annual Review of Ecology and Systematics, 13, 201-228. [ Links ]
Janzen, D. (1982a). Cenizero tree (Leguminosae: Pithecellobium saman) delayed fruit development in Costa Rican deciduous forests. American Journal of Botany, 69, 1269-1276. [ Links ]
Janzen, D. (1982b). Seeds in tapir dung in Santa Rosa National Park, Costa Rica. Brenesia, 19/20, 129-135. [ Links ]
Janzen, D. (1988). Management of habitat fragments in a tropical dry forest: Growth. Annals of th Missouri Botanical Garden, 75, 105-116. [ Links ]
Janzen, D., & Martin, P. (1982). Neotropical anachronisms: the fruits the gomphotheres ate. Science, 215, 19-27. [ Links ]
Jolaosho, A.O., Oduguwa, B.O., Onifade. O.S., & Babayemi, J.O. (2006). Effects of ingestion by cattle and immersion in hot water and acid on the germinability of rain tree (Albizia saman) seeds. Tropical Grasslands, 40, 244-253. [ Links ]
Kantak, G. (1979). Observations on some fruit-eating birds in Mexico. The Auk, 96(1), 183-186. [ Links ]
Kelly, J. (1993). The effect of nest predation on habitat selection by dusky flycatchers in limber pine-juniper woodland. The Condor, 95, 83-93. [ Links ]
López, J.N. (2001). Estructura gremial y organización de un ensamble de aves del Desierto del Monte. Tesis de Doctorado. Facultad de Ciencias Exactas y Naturales, Universidad de Buenos Aires. Buenos Aires, Argentina. [ Links ]
Mabberley, D. (1997). The plant-book: a portable dictionary of the vascular plants. Cambridge, U.K.: Cambridge University Press. [ Links ]
Martin, T. (1992). Breeding productivity considerations: what are the appropriate habitat features for management. In, J.D. Hagan (Ed.). Ecology and conservation of neotropical migrant landbirds, (pp. 455-473). Washington D.C., USA: Smithsonian Institution Press. [ Links ]
McMullan, M., Quevedo, A., & Donegan, T. (2011). Guía de Campo de las Aves de Colombia. Bogotá D.C., Colombia: Fundación ProAves. [ Links ]
Méndez, A. (2008). Lista preliminar de órdenes y familias de insectos en la cuenca hidrográfica de La Cana, Las Tunas. Fitosanidad, 12, 135-142. [ Links ]
Méndez, L.E., y Calle, Z. (2007). Árboles y arbustos de la cuenca media del río La Vieja. Cali, Colombia: CIPAV Centro para la Investigación en Sistemas Sostenibles de Producción Agropecuaria. [ Links ]
Mezquida, E. (2004). Nest site selection and nesting success of five species of passerines in a South American open Prosopis woodland. Journal of Ornithology, 145, 16-22. [ Links ]
Mills, G., Dunning, J.B., & Bates, J.M. (1989). Effects of urbanization on breeding bird community structure in southwestern desert habitats. The Condor, 91, 416-428. [ Links ]
Mills, G., Dunning, J.B., & Bates, J.M. (1991). The relationship between breeding bird density and vegetation volume. The Wilson Bulletin, 103, 468-479. [ Links ]
Morton, E. (1973). On the evolutionary advantages and disadvantages of fruit eating in tropical birds. American Naturalist, 107, 8-22. [ Links ]
Morton, M.L., Sockman, K.W., & Peterson, L.E. (1993). Nest predation in the mountain white-crowned sparrow. The Condor, 95, 72-82. [ Links ]
Muñoz, M.C., Fierro-Calderón, K., y Rivera-Gutierrez, H.F. (2007). Las aves del campus de la Universidad del Valle, una isla verde urbana en Cali-Colombia. Ornitología Colombiana, 5, 5-20. [ Links ]
Nadkarni, N., & Matelson, T. (1989). Bird use of epiphyte resources in neotropical trees. The Condor, 91, 891-907. [ Links ]
Naranjo, L. (1992). Estructura de la avifauna en un área ganadera en el Valle del Cauca, Colombia. Caldasia, 17, 55-66. [ Links ]
Naranjo, L., y Estela, F. (1999). Inventario de la avifauna de un área suburbana de la ciudad de Cali. Boletín Boletin Sociedad Antioqueña de Ornitología (SAO), 20, 11-27. [ Links ]
Nilsen, R., Skarpe, C., & Moe, S. (2009). La conducta del ganado con respecto a la distancia a los árboles en Muy Muy, Nicaragua. Agroforestería en las Américas, 47, 61-67. [ Links ]
Orejuela, J.E. (1979). Estructura de la comunidad aviaria en un guadual (Bambusa guadua) en el municipio de Jamundí, Valle, Colombia. Cespedesia, (29-30), 43-58. [ Links ]
Orejuela, J.E., Raitt, R.J., Alvarez, R.J., Benalcázar, C., y Benalcázar, F.S. (1979). Poblaciones de aves en un bosque relictual en el valle del río Cauca, cerca a Jamundí, Valle, Colombia. Cespedesia, 3, 29-42. [ Links ]
Pearson, D. (1971). Vertical stratification of birds in a tropical dry forest. The Condor, 73, 46-55. [ Links ]
Pérez-Arbeláez, E. (1990). Plantas útiles de Colombia. Medellín, Colombia: Editorial Víctor Hugo. (p. 831). [ Links ]
Prasad, S., & Sharatchandra, H. (1984). Primary production and consumption in the deciduous forest ecosystem of Bandipur in South India. Proceedings of the Indian Academy of Science (Plant Science), 93, 83-97. [ Links ]
Reyes-Gutierrez, M., Sedano, R., & Durán, S. (2002). Lista anotada de la avifauna de la Universidad del Valle, Cali, Colombia. Boletin Sociedad Antioqueña de Ornitología (SAO), 13, 12-25. [ Links ]
Rico, L. (2001). Mimosaceae R.Br. In, O. Stevens, W.D. Ulloa, C. Poo & A. Montiel (Eds.) Flora de Nicaragua, (pp. 1443-1507). San Luis, USA: Missouri Botanical Garden Press. [ Links ]
Rivera-Gutiérrez, H.F. (2006). Composición y estructura de una comunidad de aves en un área suburbana en el suroccidente colombiano. Ornitología Colombiana, 4, 28-38. [ Links ]
Rivera-Milán, F.F. (1996). Nest density and success of columbids in Puerto Rico. The Condor, 98, 100-113. [ Links ]
Sanchez-Cordero, V., & Martinez-Gallardo, R. (1998). Postdispersal fruit and seed removal by forest-dwelling rodents in a lowland rainforest in Mexico. Journal of Tropical Ecology, 14, 139-151. [ Links ]
Shochat, E., Lerman, S., Katti, M., & Lewis, D.B. (2004). Linking optimal foraging behavior to bird community structure in an urban-desert landscape: field experiments with artificial food patches. The American Naturalist, 164, 232-243. [ Links ]
Shochat, E., Lerman, S., & Anderies, J. (2010). Invasion, competition, and biodiversity loss in urban ecosystems. BioScience, 60, 199-208. [ Links ]
Shochat, E., Lerman, S., & Fernández-Juricic, E. (2010b). Birds in urban ecosystems: Population dynamics, community structure, biodiversity, and conservation. In, A. Aitkenhead-Peterson & J. Volder (Eds). Urban Ecosystem Ecology, (pp. 75-86). New York, USA: American Society of Agronomy. [ Links ]
Statsoft. (2004). Statistica (data analysis software system) version 7. StatSoft, Inc. Recuperado de: www.statsoft.com [ Links ]
Tokura, Y., Rodón, M.A., Villanueva, G., & Botero, L.F. (1996). Especies forestales del Valle del Cauca. Proyecto de Instituto Interamericano de Cooperación en la Agricultura y Corporación Autónoma Regional del Valle del Cauca. Bogotá, Colombia: Editorial Lerner. [ Links ]
Vaughan, C., Ramírez, O., Herrera, G., & Guries, R. (2007). Spatial ecology and conservation of two sloth species in a cacao landscape in Limón, Costa Rica. Biodiversity Conservation, 16, 2293-2310. [ Links ]
Velásquez-Vélez, R., Pezo, D., Skarpe, C., Ibrahim, M., Mora, J., & Benjamín, T. (2009). Selectividad animal de forrajes herbáceos y leñosos en pasturas seminaturales en Muy Muy, Nicaragua. Agroforestería en las Américas, 47, 51-60. [ Links ]
Winfree, R., Bartomeus, I., & Cariveau, D.P. (2011). Native pollinators in anthropogenic habitats. Annual Review of Ecology, Evolution, and Systematics, 42, 1-22. [ Links ]
Wishnie, M.H., Dent, D.H., Mariscal, E., Deago, E., Cedeño, E., Ibarra, E. et al. (2007). Initial performance and reforestation potential of 24 tropical tree species planted across a precipitation gradient in the Republic of Panama. Forest Ecology and Management, 243, 39-49. [ Links ]
Ziv, Y., Abramsky, Z., Kotler, B., & Subach, A. (1993). Interference competition and temporal and habitat partitioning in two gerbil species. Oikos, 66, 237-246. [ Links ]

Revista de Ciencias por Universidad del Valle se encuentra bajo una licencia Creative Commons Reconocimiento 4.0.