1 Introducción
Las bases de Schiff o iminas son compuestos orgánicos derivados de la reacción de aminas primarias con aldehídos o cetonas, que se caracterizan por presentar un doble enlace C = N y actúan como bases de Lewis. La respectiva reacción de condensación, conlleva la eliminación de agua [1]. En la última década, las investigaciones sobre bases de Schiff han resultado útiles para sintetizar nuevos compuestos de gran estabilidad y versatilidad estructural, en ocasiones, con rutas diferentes de síntesis, ya sea por vía seca [2-4] o por la típica vía húmeda. Las iminas juegan un papel importante como ligantes, como intermediarios de otras moléculas [5] y en el desarrollo de modelos estereoquímicos de grupos principales [6]. Son de gran importancia biológica, como sistemas modelo y presentan gran variedad de aplicaciones clínicas con reconocidas propiedades antibacteriales [7, 8], antifúngicas [9], anticancerígenas [10] y antiinflamatorias [11, 12]; también son utilizadas a nivel industrial como en perfumería [12-15] y en análisis químico [16]. Algunas bases de Schiff, son el resultado de la condensación de los derivados del ácido salicílico con diaminas alquílicas o alifáticas, con gran aplicación como precursores de drogas [17]; otras son derivadas de cefalosporinas y actúan como agentes antimicrobianos [18]. La diversidad de sustratos carbonílicos [19] y los grupos sustituyentes de las aminas primarias, permiten obtener bases de Schiff, con diferentes funciones, donde el enlace C = N, es esencial para la actividad biológica [20]. La inclusión de sustituyentes en la imina, promueve un gran interés por la búsqueda de nuevos compuestos con actividad biológica o catalítica.
Las iminas se coordinan a especies de metales de transición y los compuestos que forman, pueden actuar como moduladores del crecimiento de células tumorales humanas [21] o catalizan diversas reacciones de polimerización y epoxidación, entre otras [22, 23]; estos compuestos de coordinación, generalmente tienen aplicaciones en la industria [24], en química analítica y algunos presentan actividad bactericida [7, 21, 25, 26], fungicida [12], antiviral [20, 27], agroquímica [12,13], anticorrosiva [14, 15] y catalítica [28-31].
La dopamina, DA, es una biomolécula es una hormona catecolamina, que actúa como precursor de los neurotransmisores noradrenalina y epinefrina. Por su actividad electroquímica y espectroscópica, resulta útil en el desarrollo de biosensores validados para su cuantificación [32] y, además, como reactivo de partida en la síntesis de bases de Schiff, empleadas como ligantes en compuestos de coordinación con estructuras especiales, por ejemplo tripodal-trinucleares [33].
El cinamaldehído, CA, aldehido aromático, es el componente principal de la canela. Conocido por su actividad su actividad como agente antimicrobiano contra una variedad de bacterias patógenas, por lo cual se ha constituido en precursor en la síntesis de bases de Schiff con actividad biológica de importancia medicinal. Actúa como un inhibidor eficaz de corrosión, debido a su capacidad para formar una monocapa sobre la superficie a proteger [34]. El CA es un agente antifúngico, que causa daño en la pared, en la membrana celular, en el contenido citoplasmático y en otras estructuras membranosas de células fúngicas [35].
En este documento se reporta la síntesis de una base de Schiff a partir de dopamina y cinamaldehído y su caracterización por espectroscopia de IR y UV. Asimismo, los cálculos computacionales (DFT), realizados a la molécula que complementan las evidencias espectroscópicas. El procedimiento aquí planteado, difiere del propuesto por Quevedo R. y Díaz-Oviedo C. [36], en que utiliza etanol como medio de reacción y ácido acético glacial como catalizador. Además, el tiempo de reacción y la temperatura son diferentes.
2 Metodología
2.1 Síntesis de las Bases
Para la síntesis de la base de Schiff se utilizó como precursor la amina primaria dopamina, DA, en forma de clorhidrato, una solución inyectable de 200 mg/5 mL (LAB. Sanderson S. A., Reg. San. No. INVIMA 2008M-0127921R-1) y cinamaldehído, CA (Sigma-Aldrich). Las pruebas de solubilidad se emplearon etanol, diclorometano, acetona, éter etílico, n-heptano y n-hexano (Sigma-Aldrich). La rotaevaporación, requerida para la obtención del sólido, se llevó a cabo en un equipo IKA RV 8V a 180 °C y 300 rpm. Los espectros UV fueron registrados en un equipo MAPADA UV1800 con un rango de longitud de onda entre 190-1100 nm y los espectros IR en un equipo Spectrometer/Data System Nicolet 6700.
Para la obtención de la imina, se disolvieron a 60 °C, por separado, cantidades estequiométricas (1:1) de DA (400 mg, 2.61 mmol en 25 mL de etanol) y CA (415 mg, 3.14 mmol en 25 mL de etanol), con un ligero exceso del aldehído, para asegurar la reacción completa. A continuación, se mezclaron las soluciones de DA y CA, el pH de la mezcla de reacción se ajustó a 4.5 con unas gotas de ácido acético glacial, como lo sugiere Baluja y Chanda [8, 19] y se sometió a reflujo bajo agitación continua durante 10 horas. Se comprobó un solo producto de reacción, mediante cromatografía en capa fina, CCF, empleando etanol como eluyente. La mezcla de reacción, de color amarillo, se dejó enfriar a temperatura ambiente y se lavó, primero con 10 mL de una solución saturada de NaHSO3, para retirar los excesos de aldehído y después con etanol frio (5x10 mL), como lo sugiere Chigurupati et al [8, 16, 37], para retirar los residuos de aldehído y NaHSO3. El solvente se retiró por rotaevaporación y el producto sólido de color amarillo, etiquetado como BS-DA-CA, se dejó secar sobre sílica gel [38] a temperatura ambiente. Posteriormente, se realizaron las pruebas de solubilidad.
2.2 Detalles Computacionales
Se realizó una exploración del espacio conforma-cional, a nivel de dinámica molecular para la imina BS-DA-CA. La estructura inicial fue construida empleando el programa Avogadro y su geometría fue optimizada al nivel de teoría B3LYP/6-311++G**, con el paquete computacional Gaussian 16 [39], se empleó este nivel de teoría porque ha mostrado buenos resultados para las bases de Schiff [40]. La estructura resultante se utilizó como punto de partida para la realización de la dinámica molecular. La molécula fue parametrizada usando las cargas RESP, resultado de la optimización previa, y para los parámetros tales como ángulos y diedros se empleó el campo de fuerza GAFF. Estos parámetros se emplearon para la construcción del archivo de topología, mediante el empleo del módulo Leap, el cual está presente en el paquete computacional AMBER 18 [41]. Para la dinámica molecular, las ecuaciones de Newton se integraron usando un tamaño de paso de 1fs. El sistema fue minimizado y calentado de 0 a 500 K durante 2.5 ns. En conclusión, se realizó una producción de 500 ns y se tomaron fotos cada ns, 500 fotos en total. Cada una de las 500 estructuras, resultado de la dinámica, se minimizó usando mecánica molecular y un análisis de agrupamientos, con el fin de eliminar la redundancia de estructuras, todo ello con el módulo cpptraj de AMBER 18. Como resultado de la exploración, se obtuvieron 70 estructuras y cada una se optimizó con el nivel de teoría B3LYP/6-311++G**. Finalmente, para los análisis espectroscópicos y de orbitales, se tomó la molécula con la menor energía.
3 Resultados y discusión
3.1 Reacción de dopamina con cinamaldehído
Se obtuvo por condensación un sólido color amarillo, estable al aire, soluble en agua y etanol, parcialmente soluble en acetona e insoluble en n-hexano y n-heptano. Las pruebas de solubilidad indicaron la presencia de grupos polares en la molécula a consecuencia de los heteroátomos nitrógeno, proveniente del grupo amino, y oxígeno, proveniente de los hidroxilos de la dopamina, disponibles para establecer interacciones tipo puente de hidrógeno con los solventes polares agua y etanol. El compuesto presenta punto de fusión entre 88-90 °C, conservando su color.
La reacción presentó un rendimiento del 37%, calculado con base en la cantidad obtenida de imina. Con base en la estructura de la DA, la presencia de los dos grupos hidroxilo en el anillo, propicia una disminución del carácter nucleofílico del átomo de nitrógeno y, por efecto inductivo, decrece su densidad electrónica. Por su parte, el efecto de resonancia incrementa la densidad electrónica en el anillo aromático y la conjugación del aldehído a β -insaturado impone barreras de alta energía frente a la adición nucleofílica, tomando en cuenta la descripción de Quevedo R. y Díaz-Oviedo C. [36] sobre la formación de bases de Schiff a partir de β-feniletilaminas con aldehidos no enolizables, lo cual explicaría el rendimiento alcanzado.
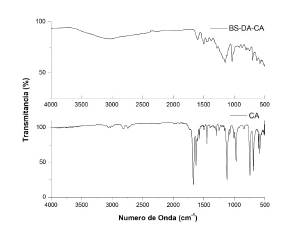
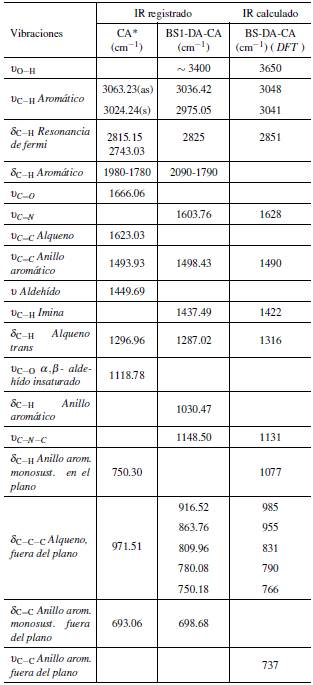
El espectro IR del CA, Figura 1, se registró una banda intensa a 1665 cm-1, característica de la frecuencia de tensión simétrica del grupo carbonilo, u s C = O, y una banda fina de intensidad media a 1449 cm-1, asignada a la tensión uC-H en el plano, del grupo aldehído [42, 43]. El espectro IR de BS-DA-CA, registró una señal de baja intensidad a 1603.76 cm-1, que se asignó a la vibración de tensión uC=N; la señal de baja intensidad a 1449 cm-1 propia de la vibración de torsión uC-H del aldehído, presentó un desplazamiento a 1437 cm-1 en la imina sintetizada. La ausencia de la banda intensa del grupo carbonilo u s C = O, propia del aldehído, permitió inferir la formación del enlace imino, C = N. Otras bandas características del cinamaldehído y del producto obtenido se indican en la Tabla 1.
La banda de tensión uC=N para la imina BS-DA-CA, esperada hacia 1650 cm-1, en el espectro se asignó a la registrada a 1603.76 cm-1, cuya menor frecuencia se explica por el efecto conjugado extendido de los grupos aromáticos [44]. La banda ancha de baja intensidad alrededor de 3400 cm-1, se asignó a la vibración de estiramiento uO-H de los grupos hidroxilo, unidos al fenilo proveniente de la dopamina [45], característica de la tensión del O-H sin puente de hidrógeno.
El espectro IR se comparó con los resultados computacionales DFT, como se indicó en la metodología, y se calculó con el método B3LYP y la base 6-311++G**, para la molécula que presentó la menor energía. Se empleó un factor de corrección de 0,964 [46] en las bandas IR (la geometría de esta molécula se puede encontrar en el material suplementario). Los resultados obtenidos y otras asignaciones se reportan en la Tabla 1. Al comparar los cálculos, se observó una total consistencia con los datos experimentales y las vibraciones asignadas.
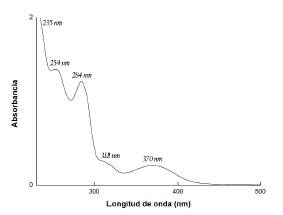
Para el análisis del espectro UV, se tomó en cuenta que el cromóforo carbonilo del CA, en su estado basal, contiene cuatro electrones de valencia en los dos orbitales σ, un par de electrones en el orbital π y dos pares de electrones no enlazantes sobre el átomo de oxígeno. La presencia de éste con sus pares electrónicos libres, hace posible las transiciones π → π *, n → σ * y n → π * , cercanas a 150, 170 y 285 nm, respectivamente. Por su parte, es bien conocido, que el espectro de un anillo bencénico debe presentar tres bandas de absorción, que para este caso con CA corresponden a 184, 204 y 256 nm: α, ρ y β respectivamente [49].
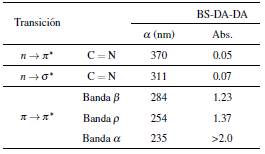
En el espectro UV de la imina BS-DA-CA,Figura 2, se registró una banda de absorción intensa, cercana a los 235 nm, que se atribuyó a la transición π → π *, debida a la deslocalización electrónica del anillo aromático del benceno proveniente del CA [50]. La banda de intensidad media, a 311 nm se atribuyó a la transición n → σ * del grupo cromóforo formado por el heteroátomo nitrógeno, N, de la imina C = N, el cual tiene un par de electrones libre. La banda de baja intensidad, que se registró a 370 nm, se atribuyó a la transición electrónica n → π * de los pares libres de los oxígenos y el anillo DA, al doble enlace C = N. Esta transición se observa con mayor claridad, en el diagrama de los orbitales resultantes del cálculo teórico, para la transición HOMO-LUMO (Figura 3). Si no hay solapamiento entre ambos orbitales, la probabilidad de que ocurra esta transición es baja y, al considerarla prohibida, se explica su baja intensidad. Las absorciones reportadas en la Tabla 2 para la imina BS-DA-CA, son características de grupos con electrones π deslocalizados y electrones libres.
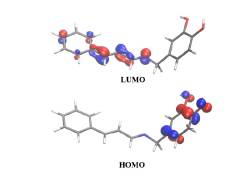
Figura 3 HOMO y LUMO, resultado del análisis de los orbitales de Kohn y Sham para la imina BS1-DA-CA.
La conjugación del anillo aromático proveniente del aldehído, CA, con un sustituyente que posee un enlace doble y un par electrónico solitario del grupo imino, C = N, y la presencia de los sustituyentes OH- provenientes de la DA, que se comportan como un auxocromo, propiciaron un desplazamiento ba-tocrómico de las bandas características del benceno libre, ya mencionadas, de 184-256 nm.
De acuerdo con la discusión realizada, se infiere la formación de la Base de Schiff o imina, 4-(2-{[(1E,2E)-3-fenilprop-2-en-1-iliden] amino}etil)benzeno-1,2-diol, BS-DA-CA (Figura 4), cuyo proceso químico se representa mediante la ecuación:
En general, en bases de Schiff con estructuras aromáticas, los anillos bencénicos confieren liposolubilidad a la molécula, aunque con la presencia de los grupos hidroxilo unidos directamente al anillo bencénico, como en el caso particular de la DA, esta tiende a disminuir [51]. LA liposolubilidad es una característica deseable en moléculas con actividad antimicrobiana, dado que las moléculas se difunden con mayor rapidez a través de la membrana celular.
De otro lado, las iminas son consideradas especies de nitrógeno reactivo, por sus pares electrónicos solitarios, imprescindibles en la respiración mito-condrial, en reacciones enzimáticas redox y en el proceso fundamental de fotosíntesis [52]. Las características descritas y la estructura de la base de Schiff, permiten predecir posibles propiedades antimicrobianas, cuya comprobación podrá constituir los objetivos de futuros trabajos, con base en la funcionalidad de los reactivos, asociada a la versatilidad de las iminas.
4 Conclusiones
Se sintetizó una base de Schiff, BS-DA-CA, a partir de dopamina con cinamaldehído. La imina obtenida corresponde a un sólido de color amarillo, soluble en agua y en solventes orgánicos polares. El compuesto se caracterizó por espectroscopia IR, la cual evidenció la formación de la especie, principalmente por ausencia de la señal típica del grupo C = O del aldehído, alrededor de 1600 cm-1 y el registro de una banda menos intensa a menor longitud de onda, 1590 cm-1, asignada al grupo C = N. El espectro UV registró las bandas propias de los anillos aromáticos y del cromóforo C = N de las iminas. Los resultados del análisis computacional, realizados con DTF, fueron congruentes con los resultados experimentales obtenidos en el espectro IR. El conjunto de los resultados y el análisis realizado, confirmamos que la base de Schiff sintetizada, corresponde a 4-(2-{[(1E,2E)-3-fenilprop-2-en-1-iliden]amino}etil)benzeno-1,2-diol.