Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Revista Colombiana de Reumatología
versão impressa ISSN 0121-8123
Rev.Colomb.Reumatol. vol.23 no.2 Bogotá abr./jun. 2016
http://dx.doi.org/10.1016/j.rcreu.2016.02.007
Artículo de revisión
Medición del grosor de la íntima-media carotídea: utilidad y diagnóstico ecográfico de aterosclerosis subclínica en enfermedades reumáticas. Revisión de la literatura
Usefulness of measuring common carotid intima-media thickness: ultrasound diagnosis of sub-clinical atherosclerosis in rheumatic diseases. A literature review
Lina María Saldarriaga Rivera*, Lucio Ventura Ríos, Cristina Hernández Díaz y Carlos Pineda Villasenor
Laboratorio de ultrasonido musculoesquelético y articular, Instituto Nacional de Rehabilitación, México D.F., México
* Autor para correspondencia. Correo electrónico: vasculitisreumato@gmail.com (L.M. Saldarriaga Rivera).
Historia del artículo: Recibido el 12 de junio de 2015 Aceptado el 25 de febrero de 2016 On-line el 31 de marzo de 2016
Resumen
Introducción: Los pacientes con enfermedades reumáticas tienen un aumento del riesgo cardiovascular debido a inflamación sistémica y disfunción endotelial, lo que promueve una acelerada aterosclerosis. Una de las formas de medir el riesgo cardiovascular es a través del grosor de la íntima-media, evaluada por ultrasonido carotídeo, el cual es un predictor de acontecimientos cardiovasculares de bajo costo y naturaleza no invasiva.
Objetivo: Revisar la evidencia que describe la utilidad y valor del diagnóstico ecográfico de aterosclerosis subclínica en enfermedades reumáticas, evaluadas mediante el grosor de la íntima-media carotídea (GIMc).
Materiales y métodos: Se realizó una revisión de la literatura de la base de datos electrónica PubMed. Se incluyeron artículos desde enero de 2005 a mayo de 2015, sin restricción de idioma. Se incluyeron estudios observacionales de cohorte que evaluaron la prevalencia de aterosclerosis subclínica mediante la medición del GIMc y estudios de metaanálisis. Se verificó la calidad metodológica de los artículos y se extrajo la información relevante de cada uno.
Resultados: Se identificaron 56 artículos que cumplieron los requisitos. El 95,7% coincidió con el aumento del GIMc en relación con el grupo control, como marcador predictivo de aterosclerosis subclínica.
Conclusiones: Los pacientes con enfermedades reumáticas tienen un aumento del riesgo cardiovascular medido a través del GIMc, como lo muestran varios estudios. Esta medición realizada por ultrasonido carotídeo podría ayudar a detectar el riesgo de enfermedad cardiovascular subclínica en estas poblaciones, lo que permitiría al clínico implementar medidas terapéuticas para reducir el riesgo de morbimortalidad en estos pacientes.
Palabras clave: Ultrasonido, Íntima-media, Carótida, Enfermedades reumáticas, Aterosclerosis, Riesgo cardiovascular.
Abstract
Introduction: Patients with rheumatic diseases have an increased cardiovascular risk due to systemic inflammation and endothelial dysfunction, which promotes accelerated atherosclerosis. One way to measure cardiovascular risk, is through the carotid intima-media thickness which is an inexpensive and non-invasive predictor of cardiovascular events.
Objective: To examine the evidence to determine the usefulness of ultrasound in the diagnosis of sub-clinical atherosclerosis in rheumatic diseases assessed by carotid intima-media thickness (IMT).
Material and methods: A systematic literature search was performed, using electronic data-bases of PubMed, for articles published from January 2005 to May 2015, with no language restriction. Observational cohort studies that assessed the prevalence of sub-clinical athe-rosclerosis using the IMT were included.
Results: A total of 56 studies were identified for analysis, with almost all (95.7%) reporting an increased IMT in relation to the control group.
Conclusions: Patients with rheumatic diseases have an increased cardiovascular risk asses-sed using IMT. This measurement, assessed by carotid ultrasound, may help detect the risk of sub-clinical cardiovascular disease in these populations, allowing to establish a therapeutic strategy to reduce the risk of morbidity and mortality in these patients.
Keywords: Ultrasound, Intima-media, Carotid, Rheumatic diseases, Atherosclerosis, Cardiovascular risk.
Introducción
La aterosclerosis es considerada una alteración patológica de las arterias caracterizada por el depósito anormal de lípidos y tejido fibroso en la pared arterial, que desorganiza la arquitectura, la función de los vasos y reduce, en forma variable, el flujo sanguíneo al miocardio1,2. Es un proceso progresivo que comienza en la adolescencia, llegando a ser clínicamente manifiesto a una edad tardía o, por el contrario, presentarse de manera subclínica3.
Las enfermedades autoinmunes sistémicas están relacionadas con un estado inflamatorio crónico, un incremento en el riesgo cardiovascular y, por consiguiente, con un aumento en la tasa de morbimortalidad, tanto por la enfermedad activa, como por el uso prolongado de esteroides4. Muchos de los factores de riesgo cardiovascular, tales como: tabaquismo, hipertensión arterial, dislipidemia y alteración en la homeos-tasis vascular, contribuyen a la activación endotelial durante las primeras etapas del desarrollo de la aterosclerosis, lo que resulta en un aumento en la expresión de moléculas de adhesión en la célula endotelial, tales como P-selectina, E-selectina, molécula de adhesión intercelular-1 y molécula de adhesión celular vascular-1 en la superficie de la célula endotelial, lo que lleva a la unión y, por último, promueve la adhesión de monocitos5,6. Después de la transmigración en la pared del vaso, los monocitos se convierten en macrófagos y posteriormente en células espumosas. El proceso continúa con la acumulación de lípidos, liberación de citoquinas y la proliferación de células musculares lisas, generando la formación de placa ateromatosa7,8.
La activación endotelial, común en las enfermedades reumáticas como artritis reumatoide (AR), lupus eritematoso sistémico (LES), síndrome de Sjögren (SS), esclerosis sisté-mica (ES), gota, osteoartritis (OA) y vasculitis, entre otras, es probablemente inducida por autoanticuerpos. Para el caso específico de las vasculitis, los anticuerpos contra el citoplasma de neutrófilos (ANCA) y, en particular, los dirigidos a la proteinasa 3 (PR3-ANCA), pueden activar las células endo-teliales como se ha demostrado in vitro9. También ocurre in vivo, por el aumento de los niveles séricos de molécula de adhesión vascular-1 y E-selectina que están implicados en el proceso de inflamación sistémica, contribuyendo a la progresión de daño cardiovascular10. En el caso de LES se propone que una alteración en la oxidación de lípidos juega un papel importante en la aterogénesis, contribuyendo a la activación del sistema inmune, desencadenando marcadores inflamatorios involucrados en la formación de la placa ateromatosa11. En la AR se ha documentado un número variable de factores para el desarrollo de aterogénesis, tales como la homocisteína, los niveles séricos alterados de lipoproteínas y el tratamiento farmacológico prolongado. Hallazgos recientes indican que la inflamación sistémica puede contribuir al desarrollo de la aterosclerosis y conferir un riesgo adicional para la muerte cardiovascular en los pacientes con AR. La proteína C reactiva, se ha considerado como un marcador pronóstico independiente para la enfermedad cardiovascular en estos pacientes12. Para tal efecto, los estudios han demostrado una estrecha asociación entre los marcadores de inflamación como proteína C reactiva, velocidad de eritrosedimentación globular y los marcadores de enfermedad cardiovascular ate-romatosa (disfunción endotelial y el aumento en el grosor de la íntima-media de la arteria carótida) en pacientes con estas enfermedades autoinmunes sistémicas, lo que incrementa significativamente la prevalencia de la enfermedad cardiovascular, como se ha reportado en AR en un 50%, similar a LES con un riesgo de enfermedad coronaria, en mujeres entre 35 y 44 años, 50 veces mayor que entre los sujetos de control de la misma edad y para las vasculitis asociadas a ANCA con un riesgo mayor a lo esperado de 2,1 (IC 1,4-3,0), para eventos cardiovasculares en los primeros 5 años de diagnóstico13,14.
El objetivo de la presente revisión pretende examinar la evidencia que describe la utilidad y valor del diagnóstico ecográfico de aterosclerosis subclínica en enfermedades reumáticas evaluadas mediante el GIMc.
Medición de grosor íntima-media
Una de las formas de medir el riesgo cardiovascular, es a través del grosor de la íntima-media por ultrasonografía, el cual es un predictor de acontecimientos cardiovasculares15. El ultrasonido modo B es una técnica no invasiva que permite la visualización de las paredes de las arterias superficiales como las ramas de la carótida15. El GIMc se ha utilizado ampliamente en la evaluación de la progresión aterosclerótica; se ha demostrado que el incremento de su grosor está asociado con una mayor prevalencia y gravedad de enfermedades coronarias y cerebrovasculares16,17.
Estudios epidemiológicos y trabajos clínico-terapéuticos de regresión con hipolipemiantes han establecido que el GIMc es un marcador sensible al cambio, válido para evaluar la progresión y regresión de enfermedad aterosclerótica, el cual sería el método más adecuado para evaluar la eficacia de las intervenciones farmacológicas y no farmacológicas, debido a que proporciona datos objetivos sobre los cambios de la pared arterial, datos de riesgo y salud de una población determinada, para favorecer la toma de medidas preventivas para disminuir la morbimortalidad y mejorar el pronóstico y, por consiguiente, la calidad de vida de los pacientes18,19.
Ultrasonido carotídeo basado en radiofrecuencia
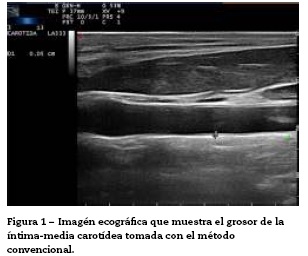
Convencionalmente, la medición del grosor de la íntima-media se lleva a cabo por el trazado manual de las interfaces entre las capas de tejido arterial (fig. 1). Cabe destacar que este método requiere alta competencia, una formación adecuada y un nivel de especialización en la técnica. Por lo general, principalmente los cardiólogos o radiólogos realizan este tipo de examen. A pesar del enfoque convencional para evaluar el GIMc todavía hay algunos aspectos que deben ser superados, como la amplia variabilidad intra- e interobservador, la cual depende del juicio de los expertos y del tiempo que tarda en realizar las mediciones del GIMc20.
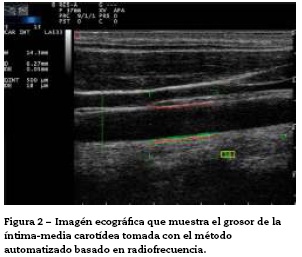
Recientemente, la técnica de ultrasonido carotídeo basado en radiofrecuencia ha sido aplicada (fig. 2). Este método parece ser menos dependiente de la experiencia del operador del ultrasonido vascular, ya que proporciona una medida automática del grosor de las interfaces de la pared arterial. Naredo et al., realizaron un estudio que tuvo como objetivo evaluar la fiabilidad del ultrasonido automatizado basado en radiofrecuencia, comparándolo con el modo B del método convencional, en pacientes con AR, demostrando que la técnica es válida, reproducible y confiable (intraobservador 0,61 y 0,85 interobservador) para evaluar el riesgo cardiovascular por el reumatólogo21.
Por su parte Di Geso et al., también compararon ambos métodos en 32 pacientes con enfermedades reumáticas inflamatorias crónicas. Un cardiólogo experto empleó el método manual convencional y un reumatólogo utilizó el método automatizado para medir el grosor de la íntima-media. Se observó una buena concordancia entre los dos métodos (0,69 y 0,77, para la carótida común derecha e izquierda, respectivamente). Sustancialmente se identificaron buenas concordancias entre los evaluadores que adoptaron la técnica manual convencional y el software automatizado22.
Más recientemente, Naredo et al., realizaron un estudio longitudinal, prospectivo, multicéntrico, para comparar el GIMc, evaluado por el método automatizado en 94 pacientes con AR tratados con drogas modificadoras de la enfermedad (DMARD) sintéticos vs. DMARD biológicos, en comparación con 94 controles. El GIMc fue significativamente mayor en los pacientes con AR tratados solo con DMARD sintéticos que en los controles (591,4 frente a 562,1; p = 0,035) y en pacientes tratados con DMARD sintéticos más biológicos vs. controles (591,4 vs. 558,8; p = 0,040). Los resultados sugieren que el ultrasonido carotídeo puede mostrar diferencias significativas entre los pacientes con AR dependiendo del tratamiento que reciben23. La ventaja del método automatizado es que es más rápido que el convencional. La variación interobservador para la detección de placas es variable, depende del nivel de preparación del ecografista y de la calidad de la imagen ecográfica24.
Materiales y métodos
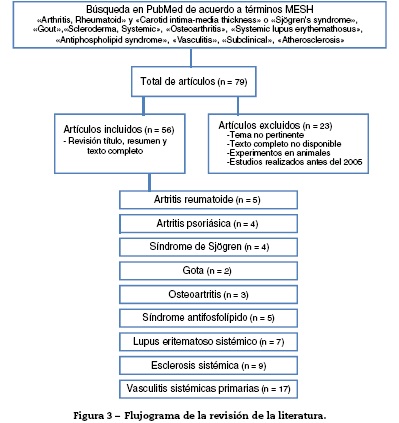
Se realizó una revisión de la literatura en la base de datos Pub-Med, de estudios observacionales de cohorte y metaanálisis publicados entre enero de 2005 y mayo de 2015, sin restricción de idioma, incluyendo finalmente aquellos en español, inglés y portugués. Se verificó la calidad metodológica de los artículos y se extrajo la información relevante de cada uno. Se excluyeron artículos en los cuales los estudios no fueran realizados en humanos, el tema no fuera pertinente, el texto completo no estuviera disponible o hubieran sido publicados antes del 2005. Para la búsqueda se utilizaron términos MESH que incluyeron «arthritis, rheumatoid» y «carotid intima-media thickness» o «Sjogren's syndrome», «gout», «scleroderma, systemic», «osteoarthritis», «systemic lupus erythemathosus», «antiphospholipid syndrome», «vasculitis», «subclinical», «atherosclerosis.
Se seleccionaron artículos por título y resumen, se verificó si era pertinente y se realizó la revisión del artículo completo. De los artículos seleccionados, mediante un formato de recolección se obtuvieron datos relevantes respecto al GIMc y formación de placas ateromatosas en cada una de las diferentes patologías reumáticas, comparados con el grupo control (fig. 3). Las citas bibliográficas de cada artículo se revisaron en busca de literatura no recuperada en la búsqueda inicial.
Grosor de la íntima-media carotídea en enfermedades reumáticas
Existen pocos estudios en la literatura en cuanto a la medición del GIMc en pacientes con enfermedades reumáticas, publicados en los últimos 10 años (tabla 1).
Artritis reumatoide
Los pacientes con AR tienen una esperanza de vida reducida y una alta morbimortalidad cardiovascular en comparación con la población general. Un metaanálisis analizó la AR en relación con los marcadores de riesgo cardiovascular y la presencia de placas carotídeas, encontrando 51 estudios con datos del GIMc (3.600 pacientes con AR y 3.020 controles) y 35 estudios que informaron sobre la prevalencia de placas ateromatosas (2.859 pacientes con AR y 2.303 controles). Los pacientes con AR mostraron un incremento significativo del GIMc respecto a los controles. Los hombres tuvieron un estado inflamatorio más grave25. Por otro lado, Carotti et al., encontraron una acelerada aterosclerosis por aumento del GIMc en 40 pacientes con AR, mayor que en el grupo control26. Un estudio colombiano demostró que el 54% de los pacientes con AR presentaba un GIMc mayor de 0,91 mm correlacionándolo con ateroscle-rosis subclínica severa, al igual que los estudios realizados por González-Juanatey, Mohan y Vázquez-Del Mercado, en los cuales también se demuestra un aumento en el GIMc en esta patología reumática27-30.
Artritis psoriásica
Gutiérrez et al., determinaron la prevalencia de aterosclerosis carotídea subclínica en 216 pacientes con AR o artritis pso-riásica, utilizando el método automatizado, observaron que un 66% con AR y un 67% con artritis psoriásica tuvieron un incremento marcado en el GIMc sin evidencia clínica31. En otro estudio, se evaluó la relación del síndrome metabólico y el GIMc entre 343 pacientes con psoriasis o artritis psoriá-sica. El 42,2% de pacientes con psoriasis y el 57% con artritis psoriásica tuvieron mayor prevalencia de síndrome metabó-lico y mediciones mayores del GIMc que los pacientes con psoriasis, lo que contribuye a un mayor riesgo de enfermedad cardiovascular32.
Mazlan et al., estudiaron el GIMc y los factores de riesgo cardiovascular en una población de 63 pacientes con artritis psoriásica, usando el método convencional, demostrando una asociación significativa entre el riesgo cardiovascular con el incremento del GIMc, sin embargo, no hubo asociación con el estado de actividad de la enfermedad33. González-Juanatey et al., demostraron una mayor prevalencia de aterosclerosis subclínica en 59 pacientes con artritis psoriásica, con respecto a los controles34.
Síndrome de Sjögren
Existen algunos datos sobre el riesgo de eventos cardiovasculares en el SS, en relación con la presencia de valvulopatías, derrame pericárdico, hipertensión pulmonar, pero pocos con medición del GIMc35. Bartoloni et al., analizaron retrospectivamente una cohorte de 1.343 pacientes que fue comparada con un subgrupo de 788 pacientes de género femenino, en edades comprendidas entre 35-74 años y 4.774 mujeres sanas de la misma edad, encontrando mayor prevalencia de factores de riesgo cardiovascular como hipertensión arterial sistémica e hipercolesterolemia36. De igual manera lo demuestra el estudio realizado por Kang et al., donde la hiperlipidemia y las arritmias cardiacas son las principales causas de comorbilidad en los pacientes con SS37.
Se han reportado 4 estudios en los últimos 10 años con respecto a la medición del GIMc. Los 2 primeros realizados por Vaudo et al., y Gravani et al., quienes demostraron un incremento en el GIMc con respecto al grupo control38,39. En contraposición con 2 estudios realizados por Zardi et al., y Akyel et al., en los cuales no hubo diferencia significativa en cuanto al GIMc con respecto al grupo control40,41.
Gota
En lo que respecta a la artritis gotosa solo existen 2 reportes en la literatura relacionados con la evaluación del GIMc y la ate-rosclerosis subclínica. Cukurova et al., estudiaron 55 pacientes con gota, encontrando un incremento en el GIMc con respecto al grupo de pacientes con hiperuricemia asintomática. Il'ina et al., en una población de 89 pacientes con gota, demostraron que 37 tenían placas ateromatosas42,43.
Esclerosis sistémica
Los pacientes con ES tienen mayor prevalencia de formación de placas ateromatosas con respecto al grupo control, tal como lo demostraron Schiopu et al. En contraste, en otro estudio se demostró un leve incremento del GIMc, pero sin significación estadística con respecto al grupo control44.
En una revisión sistemática, se incluyeron 14 estudios que evaluaron el GIMc, reportando una alta prevalencia de ateros-clerosis subclínica en estos pacientes45-47. En los últimos 10 años, se han reportado en la literatura varios estudios que analizan el incremento del GIMc en pacientes con ES, como marcador predictivo de aterosclerosis subclínica. Un estudio realizado por Vettori et al., reportó aterosclerosis subclínica en 14/50 pacientes, correlacionando el GIMc con la edad avanzada y el uso prolongado de corticosteroides48. Tsifetaki et al., también describieron, en una población con 60 pacientes de ES, mayor prevalencia del GIMc comparado con el grupo control49. Bartoli et al., demuestran que el GIMc es indicador de enfermedad cardiovascular subclínica en su población de 35 pacientes con ES, donde el GIMc es mayor al compararlo con el grupo control, al igual que en el estudio realizado por Sherer et al50,51.
Szucs et al., demostraron que la edad y la duración de la enfermedad son directamente proporcionales al aumento del GIMc52.
Osteoartritis
Se encontraron 3 estudios, 2 de ellos con una muestra representativa. En el estudio ROTTERDAM que incluyó 2.372 hombres y 3.278 mujeres, se observó aumento del GIMc particularmente en mujeres con OA de rodilla, también mayor formación de placas carotídeas en pacientes con OA de metacarpofalángicas e interfalángicas distales53. El estudio AGES-REYKJAVIK analizó una población de 2.195 hombres y 2.975 mujeres con OA de cadera y rodilla, encontrando que los pacientes con reemplazo total de la articulación tuvieron mayor severidad en cuanto a la formación de placas carotídeas54. Finalmente, un estudio pequeño realizado por Koutroumpas et al., demostró en 24 pacientes incremento del GIMc en OA erosiva55.
Lupus eritematoso sistémico
Existen varios estudios realizados que valoran el aumento del GIMc en esta enfermedad, la mayoría de ellos han demostrado su incremento con respecto a los controles. El estudio realizado por Frerix et al., con una población incluyente de 100 pacientes con LES y 90 con ES, revela la existencia de ateroscle-rosis subclínica medida por el GIMc en 26,5% de los pacientes con LES, frente al 28,9% de ES56. Kao et al., demuestran que los pacientes que han tenido incidentes cardiovasculares tienen mayor GIMc y formación de placas carotídeas en comparación con la población lúpica sin eventos previos cardiovasculares57.
Telles et al., evaluaron la progresión de la aterosclerosis en una cohorte de 181 pacientes lúpicos, de los cuales 157 fueron reevaluados después de 39 meses, demostrando en el 19,7% un aumento del GIMc58. El aumento en el GIMc también fue detectado en 15,4% en pacientes con nefritis lúpica59. Solo un estudio no mostró diferencias significativas en cuanto al GIMc versus el grupo control60. En cuanto a la formación de placas ateromatosas, 2 estudios reportaron su incremento, siendo el más reciente de ellos realizado por Hernández et al., el cual mostró que el 35,5% de la población con LES presentaba placas carotídeas61,62.
Síndrome antifosfolípido
En lo que respecta a este síndrome, solo se encontraron 5 publicaciones, 3 de ellas reportaron un incremento marcado en el GIMc con respecto al grupo control, en contraposición con el estudio de Reshetniak et al., que no mostró diferencias significativas63-66. En un estudio comparativo entre síndrome antifosfolípido y LES, se evidenció que el síndrome antifosfo-lípido presenta mayor incremento del GIMc (48,3%) que el LES, sin embargo no se estableció ninguna relación significativa entre el tipo de anticuerpos antifosfolípidos con los cambios del GIMc67.
Vasculitis sistémicas primarias
En relación a las vasculitis sistémicas primarias, los estudios son pocos. Las patologías más estudiadas en los últimos 10 años, por orden de frecuencia, son: enfermedad de Behcet68-74, enfermedad de Kawasaki75-78, arteritis de Takayasu79-81, GPA-Wegener y, finalmente, arteritis de células gigantes82,83. Para la arteritis de Takayasu, un estudio realizado por Seth et al., sugiere que el GIMc puede ser un posible marcador de actividad de la enfermedad. En este estudio se evaluaron 74 arterias carótidas comunes en 37 pacientes con arteritis de Takayasu y 28 controles sanos, correlacionando sus datos con la presencia de actividad según criterios clínicos. Los resultados encontrados fueron mayor GIMc en 59% de la población estudiada, siendo prevalente en los pacientes que presentaban actividad de la enfermedad, teniendo la medición del GIMc una sensibilidad de 82% y una especificidad de 60%, como marcador de actividad77.
No se encuentran estudios con vasculitis de pequeños vasos asociada a ANCA del tipo granulomatosis eosinofílica con poliangeítis (Churg-Strauss) y poliangeítis microscópica. En todos los estudios analizados existe un marcado incremento en el GIMc con respecto al grupo control84.
Conclusión
Los pacientes con enfermedades reumáticas tienen un aumento del riesgo cardiovascular evaluado a través del GIMc, como lo demuestran varios estudios. Esta medición podría ayudar a detectar el riesgo de enfermedad cardiovascular sub-clínica en estas poblaciones, lo que permitiría al reumatólogo, en práctica clínica, implementar medidas terapéuticas oportunas para reducir la morbimortalidad, que ya de por sí está incrementada. La técnica ultrasonográfica automatizada por radiofrecuencia es todavía poco utilizada en reumatología, sin embargo, se ha demostrado que es útil, válida, accesible, repro-ducible y confiable, por lo que se espera que en el futuro la evaluación del riesgo cardiovascular en los pacientes reumáticos forme parte de la evaluación cotidiana.
Financiación
Ninguna.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
1. Suárez Loaiza J. Fisiopatología de la aterosclerosis. Rev Costarric Cardiol. 2001;3:54-63. [ Links ]
2. Ross R. Atherosclerosis - an inflammatory disease. N Engl J Med. 1999;340:115-26. [ Links ]
3. Libby P, Ridker PM, Maseri A. Inflammation and atherosclerosis. Circulation. 2002;105:1135-43. [ Links ]
4. Amaya-Amaya J, Montoya-Sánchez L, Rojas-Villarraga A. Cardiovascular involvement in autoimmune diseases. Biomed Res Int. 2014;3673:367359, http://dx.doi.org/10.1155/ 2014/367359. [ Links ]
5. Filer AD, Gardner-Medwin JM, Thambyrajah J, Raza K, Carruthers DM, Stevens RJ, et al Diffuse endothelial dysfunction is common to ANCA associated systemic vasculitis and polyarteritis nodosa. Ann Rheum Dis. 2003;62:162-7. [ Links ]
6. Booth AD, Wallace S, McEniery CM, Yasmin, Brown J, Jayne DR, et al. Inflammation and arterial stiffness in systemic vasculitis: a model of vascular inflammation. Arthritis Rheum. 2004;50:581-8. [ Links ]
7. Morgan MD, Turnbull J, Selamet U, Kaur-Hayer M, Nightingale P, Ferro CJ, et al. Increased incidence of cardiovascular events in patients with antineutrophil cytoplasmic antibody-associated vasculitides: a matched-pair cohort study. Arthritis Rheum. 2009;60:3493-500. [ Links ]
8. Galis ZS, Khatri JJ. Matrix metalloproteinases in vascular remodeling and atherogenesis: the good, the bad, and the ugly. Circ Res. 2002;90:251-62. [ Links ]
9. Faia KL, Davis WP, Marone AJ, Foxall TL. Matrix metalloproteinases and tissue inhibitors of metalloproteinases in hamster aortic atherosclerosis: correlation with in-situ zymography. Atherosclerosis. 2002;160:325-37. [ Links ]
10. Monach PA. Biomarkers in vasculitis. Curr Opi Rheumatol. 2014;26:24-30. [ Links ]
11. Esdaile JM, Abrahamowicz M, Grodzicky T, Li Y, Panaritis C, Du Berger R, et al. Traditional Framingham risk factors fail to fully account for accelerated atherosclerosis in systemic lupus erythematosus. Arthritis Rheum. 2001;44:2331-7. [ Links ]
12. Corrales A, Dessein PH, Tsang L, Pina T, Blanco R, Gonzalez-Juanatey C, et al. Carotid artery plaque in women with rheumatoid arthritis and low estimated cardiovascular disease risk: a cross-sectional study. Arthritis Res Ther. 2015;17:55. [ Links ]
13. Faurschou M, Mellemkjaer L, Sorensen IJ, Thomsen BS, Dreyer L, Baslund B. Increased morbidity from ischemic heart disease in patients with Wegener's granulomatosis. Arthritis Rheum. 2009;60:1187-92. [ Links ]
14. Karrar A, Sequeira W, Block JA. Coronary artery disease in systemic lupus erythematosus: a review of the literature. Semin Arthritis Rheum. 2001;30:436-43. [ Links ]
15. Chain S, Luciardi HL, Feldman G, Valberdi A. El espesor íntima-media carotídeo, un marcador de ateroesclerosis subclínica y riesgo cardiovascular. Importancia de su valoración y dificultades en su interpretación. Rev Fed Arg Cardiol. 2005;34:392-402. [ Links ]
16. Carrizo A, Tazar J, Mendia A, Sánchez N, Bossi A. Correlación del espesor íntima-media de arterias carótidas con parámetros ecocardiográficos, factores de riesgos y eventos cardiovasculares. Insuf Card. 2013;8:112-8. [ Links ]
17. González A, Arrieta T, Solís L, Pérez M, Ramírez M. Estudio con ultrasonido Doppler color en la caracterización de la enfermedad ateroesclerótica carotídea oclusiva asintomática. Rev Chil Radiol. 2009;15:110-21. [ Links ]
18. Graua M, Subiranaa I, Agisb D, Ramosd R, Basagaüab X, Martid R, et al. Grosor íntima-media carotídeo en población española: valores de referencia y asociación con los factores de riesgo cardiovascular. Rev Esp Cardiol. 2012;65:1086-93. [ Links ]
19. Baldassarre D, Nyyssónen K, Rauramaa R, de Faire U, Hamsten A, Smit AJ, et al., IMPROVE study group. Cross-sectional analysis of baseline data to identify the major determinants of carotid intima-media thicknes in a European population: the IMPROV study. Eur Heart J. 2010;31:614-22. [ Links ]
20. Hoeks AP, Willekes C, Boutouyrie P, Brands PJ, Willinger JM, Reneman RS. Automated detection of local artery well thickness based on M-line signal processing. Ultrasound Med Biol. 1997;23:1017-23. [ Links ]
21. Naredo E, Moller I, Gutiérrez M, Bong D, Cobo T, Corominas H, et al. Multi-examiner reliability of automated radio frequency-based ultrasound measurements of common carotid intima-media thickness in rheumatoid arthritis. Rheumatology (Oxford). 2011;50:1860-4. [ Links ]
22. Di Geso L, Zardi EM, Afeltra A, Salaffi F, Carotti M, Gutiérrez M, et al. Comparison between conventional and automated software-guide ultrasound assessment of bilateral common carotids intima-media thickness in patients with rheumatic diseases. Clin Rheumatol. 2012;31:881-4. [ Links ]
23. Naredo E, Moller I, Corrales A, Bong DA, Cobo-Ibanez T, Corominas H, et al. Automated radiofrequency-based US measurement of common carotid intimamedia thickness in RA patients treated with synthetic vs synthetic and biologic DMARDs. Rheumatology. 2013;52:376-81. [ Links ]
24. Touboul PJ, Hennerici MG, Meairs S, Adams H, Amarenco P, Bornstein N, et al. Mannheim carotid intima-media thickness consensus (2004-2006). An 80 update on behalf of the Advisory Board of the 3rd and 4th Watching the Risk Symposium, 13th and 15th European Stroke Conferences, Mannheim. Germany, 2004, and Brussels, Belgium, 2006. Cerebrovasc Dis. 2007;23:75-80. [ Links ]
25. Ambrosino P, Lupoli R, di Minno A, Tasso M, Peluso R, di Minno MN. Subclinical atherosclerosis in patients with rheumatoid arthritis. A meta-analysis of literature studies. Thromb Haemost. 2015;113:916-30. [ Links ]
26. Carotti M, Salaffi F, Mangiacotti M, Cerioni A, Giuseppetti GM, Grassi W. Atherosclerosis in rheumatoid arthritis: the role of high-resolution B mode ultrasound in the measurement of the arterial intima-media thickness. Reumatismo. 2007;59:38-49. [ Links ]
27. Rojas-Villarraga A, Ortega-Hernández OD, Gómez LF, Pardo AL, López-Guzmán S, Arango-Ferreira C, et al. Risk factors associated with different stages of atherosclerosis in Colombian patients with rheumatoid arthritis. Semin Arthritis Rheum. 2008;38:71-82. [ Links ]
28. González-Juanatey, Llorca J, González-Gay MA. Correlation between endothelial function and carotid atherosclerosis in rheumatoid arthritis patients with long-standing disease. Arthritis Res Ther. 2011;13:101. [ Links ]
29. Mohan A, Sada S, Siddhartha BK, Sarma KVS, Devi V, Srinivasa PVLN, et al. Subclinical atherosclerosis in patients with rheumatoid arthritis by utilizing carotid intima-media thickness as a surrogate marker. Indian J Med Res. 2014;140:379-86. [ Links ]
30. Vázquez-Del Mercado M, Nunez-Atahualpa L, Figueroa-Sánchez M, Gómez-Barnielos E, Rocha-Muiioz AD, Martín-Márquez BT, et al. Serum levels of anticyclic citrullinated peptide antibodies, interleukin-6, tumor necrosis factor-a, and C-reactive protein are associated with increased carotid intima-media thickness: a cross-sectional analysis of a cohort of rheumatoid arthritis patients without cardiovascular risk factors. Biomed Res Int. 2015;2015:342-649. [ Links ]
31. Gutiérrez M, Naredo E, di Geso L, Moller I, Lagnocco A, Salaffi F, et al. Prevalence of sub-clinical carotid atherosclerosis in patients with rheumatoid arthritis and psoriatic arthritis: a new automated radiofrequency-based ultrasound measurement of common intima-media thickness. Ann Rheum Dis. 2014;71(S3):301-2. [ Links ]
32. Lin YC, Dalal D, Churton S, Brennan DM, Korman NJ, Kim ES, et al. Relationship between metabolic syndrome and carotid intima-media thickness: cross-sectional comparison between psoriasis and psoriatic arthritis. Arthritis Care Res (Hoboken). 2014;66:97-103. [ Links ]
33. Mazlan SA, bin Mohamed Said MS, Hussein H, binti Shamsuddin K, Shah SA, Basri H. A study of intima media thickness and their cardiovascular risk factors in patients with psoriatic arthritis. Acta Med (Hradec Kralove). 2009;52:107-16. [ Links ]
34. González-Juanatey C, Llorca J, Amigo-Díaz E, Dierssen T, Martin J, González-Gay MA. High prevalence of subclinical atherosclerosis in psoriatic arthritis patients without clinically evident cardiovascular disease or classic atherosclerosis risk factors. Arthritis Rheum. 2007;57:1074-80. [ Links ]
35. Vassiliou VA, Moyssakis I, Boki KA, Moutsopoulos HM. Is the heart affected in primary Sjögren's syndrome? An echocardiographic study. Clin Exp Rheumatol. 2008;26:109-12. [ Links ]
36. Bartoloni E, Baldini C, Schillaci G, Quartuccio L, Priori R, Carubbi F, et al. Cardiovascular disease risk burden in primary Sjögren's syndrome: results of a population-based multicentre cohort study. J Intern Med. 2015;278:185-92. [ Links ]
37. Kang JH, Lin HC. Comorbidities in patients with primary Sjogren's syndrome: a registry-based case-control study. J Rheumatol. 2010;37:1188-94. [ Links ]
38. Vaudo G, Bocci EB, Shoenfeld Y, Schillaci G, Wu R, del Papa N, et al. Precocious intima-media thickening in patients with primary Sjögren's syndrome. Arthritis Rheum. 2005;52: 3890-7. [ Links ]
39. Gravani F, Papadaki I, Antypa E, Nezos A, Masselou K, Ioakeimidis D, et al. Subclinical atherosclerosis and impaired bone health in patients with primary Sjogren's syndrome: prevalence, clinical and laboratory associations. Arthritis Res Ther. 2015:17-99. [ Links ]
40. Zardi EM, Sambataro G, Basta F, Margiotta DP, Afeltra AM. Subclinical carotid atherosclerosis in elderly patients with primary Sjögren syndrome: a duplex Doppler sonographic study. Int J Immunopathol Pharmacol. 2014;27:645-51. [ Links ]
41. Akyel A, Tavil Y, Yayla C, Tufan A, Kaya A, Tezcan ME, et al. Endothelial dysfunction in primary Sjögren syndrome. West Indian Med J. 2012;61:870-2. [ Links ]
42. gukurova S, Pamuk ÓN, Ünlü E, Pamuk GE, gakir N. Subclinical atherosclerosis in gouty arthritis patients: a comparative study. Rheumatol Int. 2012;32:1769-73. [ Links ]
43. Il'ina AE, Varfolomeeva EI, Volkov AV, Mach ES, Aleksandrova EN, Novikov AA, et al. Relationship between the intima-media complex thickness, the risk factors of cardiovascular diseases, and the level of C-reactive protein in gouty patients. Ter Arkh. 2009;81:45-9. [ Links ]
44. Schiopu E, Au KM, McMahon MA, Kaplan MJ, Divekar A, Singh RR, et al. Prevalence of subclinical atherosclerosis is increased in systemic sclerosis and is associated with serum proteins: a cross-sectional, controlled study of carotid ultrasound. Rheumatology (Oxford). 2014;53:704-13. [ Links ]
45. Au K, Singh MK, Bodukam V, Bae S, Maranian P, Ogawa R, et al. Atherosclerosis in systemic sclerosis: a systematic review and meta-analysis. Arthritis Rheum. 2011;63:2078-90. [ Links ]
46. Macedo R, Andretta M, Albers C, Skare T, Ribas-Filho JM, Czeczko NG. Evaluation of carotid artery intima-media complex thickness as a marker of vascular damage secondary to accelerated atherogenesis in progressive systemic sclerosis. Rev Col Bras Cir. 2012;39:10-5. [ Links ]
47. Piccione MC, Bagnato G, Zito C, di Bella G, Caliri A, Catalano M, et al. Early identification of vascular damage in patients with systemic sclerosis. Angiology. 2011;62:338-43. [ Links ]
48. Vettori S, Maresca L, Cuomo G, Abbadessa S, Leonardo G, Valentini G. Clinical and subclinical atherosclerosis in systemic sclerosis: consequences of previous corticosteroid treatment. Scand J Rheumatol. 2010;39:485-9. [ Links ]
49. Tsifetaki N, Georgiadis AN, Alamanos Y, Fanis S, Argyropoulou MI, Drosos AA. Subclinical atherosclerosis in scleroderma patients Scand J Rheumatol. 2010;39:326-9. [ Links ]
50. Bartoli F, Blagojevic J, Bacci M, Fiori G, Tempestini A, Conforti ML, et al. Flow-mediated vasodilation and carotid intima-media thickness in systemic sclerosis. Ann N Y Acad Sci. 2007;1108:283-90. [ Links ]
51. Sherer Y, Cerinic MM, Bartoli F, Blagojevic J, Conforti ML, Gilburd B, et al. Early atherosclerosis and autoantibodies to heat-shock proteins and oxidized LD in systemic sclerosis. Ann N Y Acad Sci. 2007;1108:259-67. [ Links ]
52. Szucs G, Tímár O, Szekanecz Z, Dér H, Kerekes G, Szamosi S, et al. Endothelial dysfunction precedes atherosclerosis in systemic sclerosis relevance for prevention of vascular complications. Rheumatology (Oxford). 2007;46:759-62. [ Links ]
53. Hoeven TA, Kavousi M, Clockaerts S, Kerkhof HJ, van Meurs JB, Franco O, et al. Association of atherosclerosis with presence and progression of osteoarthritis: the Rotterdam Study. Ann Rheum Dis. 2013;72:646-51. [ Links ]
54. Jonsson H, Helgadottir GP, Aspelund T, Eiriksdottir G, Sigurdsson S, Siggeirsdottir K, et al. The presence of total knee or hip replacements due to osteoarthritis enhances the positive association between hand osteoarthritis and atherosclerosis in women: the AGES-Reykjavik study. Ann Rheum Dis. 2011;70:1087-90. [ Links ]
55. Koutroumpas A, Giannoukas A, Zintzaras E, Exarchou E, Baliakos A, Makaritsis K, et al. Erosive hand osteoarthritis is associated with subclinical atherosclerosis and endothelial dysfunction. Int J Biomed Sci. 2013;9:217-23. [ Links ]
56. Frerix M, Stegbauer J, Kreuter A, Weiner SM. Atherosclerotic plaques occur in absence of intima-media thickening in both systemic sclerosis and systemic lupus erythematosus: a duplexsonography study of carotid and femoral arteries and follow-up for cardiovascular events. Arthritis Res Ther. 2014;16:R54. [ Links ]
57. Kao AH, Lertratanakul A, Elliott JR, Sattar A, Santelices L, Shaw P, et al. Relation of carotid intima-media thickness and plaque with incident cardiovascular events in women with systemic lupus erythematosus. Am J Cardiol. 2013;112:1025-32. [ Links ]
58. Telles RW, Lanna CC, Sousa AJ, Navarro TP, Souza FL, Rodrigues LA, et al. Progression of carotid atherosclerosis in patients with systemic lupus erythematosus. Clin Rheumatol. 2013;32:1293-300. [ Links ]
59. Shaharir SS, Mohamed Said MS, Kong NC. Predictors of thickened carotid intima media thickness among well controlled lupus nephritis patients in a Malaysian tertiary centre. Reumatismo. 2012;64:341-9. [ Links ]
60. Gallelli B, Burdick L, Quaglini S, Banfi G, Novembrino C, Bamonti F, et al. Carotid plaques in patients with long-term lupus nephritis. Clin Exp Rheumatol. 2010;28:386-92. [ Links ]
61. Hernández Y, Guibert ZM, Reyes GA. Correlación de las cifras de proteína C reactiva y aterosclerosis en pacientes con lupus eritematoso sistémico. Rev Cuba Reumatol. 2015;17:126-31. [ Links ]
62. Telles RW, Lanna CC, Ferreira GA, Souza AJ, Navarro TP, Ribeiro AL. Carotid atherosclerotic alterations in systemic lupus erythematosus patients treated at a Brazilian university setting. Lupus. 2008;17:105-13. [ Links ]
63. Margarita A, Batuca J, Scenna G, Alves JD, López L, Iannaccone L, et al. Subclinical atherosclerosis in primary antiphospholipid syndrome. Ann N Y Acad Sci. 2007;1108:475-80. [ Links ]
64. Belizna CC, Richard V, Primard E, Kerleau JM, Cailleux N, Louvel JP, et al. Early atherom in primary and secondary antiphospholipid syndrome: an intrinsic finding. Semin Arthritis Rheum. 2008;37:373-80. [ Links ]
65. Ames PR, Antinolfi I, Scenna G, Gaeta G, Margaglione M, Margarita A. Atherosclerosis in thrombotic primary antiphospholipid syndrome. J Thromb Haemost. 2009;7:537-42. [ Links ]
66. Reshetniak TM, Seredavkina NV, Mach ES, Aleksandrova EN, Novikov AA, Cherkasova MV, et al. Subclinical and clinical manifestations of atherosclerosis in antiphospholipid syndrome. Ter Arkh. 2008;80:60-7. [ Links ]
67. Djokovic A, Stojanovich LJ, Stanisavljevic N, Bisenic V, Radovanovic S, Soldatovic I, et al. Does the presence of secondary antiphospholipi syndrome in patients with systemic lupus erythematodes accelerate carotid arteries intima-media thickness changes? Rheumatol Int. 2014;34:321-7. [ Links ]
68. Ozturk C, Balta S, Balta I, Demirkol S, Celik T, Turker T, et al. Neutrophil-lymphocyte ratio and carotid-intima media thickness in patients with Behcet disease without cardiovascular involvement. Angiology. 2015;66:291-6. [ Links ]
69. Messedi M, Frigui M, Ben Mahfoudh K, Feki H, Ben Mahfoudh ST, Mnif J, et al. Intima-media thickness of carotid artery in patients with Behcet's disease. Arch Med Res. 2011;42:398-404. [ Links ]
70. Hong SN, Park JC, Yoon NS, Lee SR, Kim KH, Hong YJ, et al. Carotid artery intima-media thickness in Behcet's disease patients without significant cardiovascular involvement. Korean J Intern Med. 2008;23:87-3. [ Links ]
71. Oztürk MA, Unverdi S, Oktar SO, Bukan N, Gülbahar O, Ureten K, et al. Vascular endothelial growth factor and carotid intima-media thickness in patients with Behcet's disease. Clin Rheumatol. 2008;27:961-6. [ Links ]
72. Rhee MY, Chang HK, Kim SK. Intima-media thickness and arterial stiffness of carotid artery in Korean patients with Behcet's disease. J Korean Med Sci. 2007;22:387-92. [ Links ]
73. Oztürk MA Oktar SO, Unverdi S, Ureten K, Góker B, Haznedaroglu S, et al. Morphologic evidence of subclinical atherosclerosis obtained by carotid ultrasonography in patients with Behcet's disease. Rheumatol Int. 2006;26:867-72. [ Links ]
74. Keser G, Aksu K, Tamsel S, Ozmen M, Kitapcioglu G, Kabaroglu C, et al. Increased thickness of the carotid artery intima-media assessed by ultrasonography in Behcet's disease. Clin Exp Rheumatol. 2005;23(S38):71-6. [ Links ]
75. Wu TH, Kuo HC, Tain YL, Lin KM, Kuo HC, Chien SJ. Common carotid artery intima-media thickness is useful for diagnosis of the acute stage of Kawasaki disease. BMC Pediatr. 2014;14:98. [ Links ]
76. Meena RS, Rohit M, Gupta A, Singh S. Carotid intima-media thickness in children with Kawasaki disease. Rheumatol Int. 2014;34:1117-21. [ Links ]
77. Noto N, Okada T, Abe Y, Miyashita M, Kanamaru H, Karasawa K, et al. Characteristics of earlier atherosclerotic involvement in adolescent patients with Kawasaki disease and coronary artery lesions: significance of gray scale median on B-mode ultrasound. Atherosclerosis. 2012;222:106-9. [ Links ]
78. Cheung YF, Wong SJ, Ho MH. Relationship between carotid intima-media thickness and arterial stiffness in children after Kawasaki disease. Arch Dis Child. 2007;92:43-7. [ Links ]
79. Alibaz-Oner F, Yurdakul S, Aytekin S, Direskeneli H. Impaired endothelial function in patients with Takayasu's arteritis. Acta Cardiol. 2014;69:45-9. [ Links ]
80. Schinkel AF, van den Oord SC, van der Steen AF, van Laar JA, Sijbrands EJ. Utility of contrast-enhanced ultrasound for the assessment of the carotid artery wall in patients with Takayasu or giant cell arteritis. Eur Heart J Cardiovasc Imaging. 2014;15:541-6. [ Links ]
81. Seth S, Goyal NK, Jagia P, Gulati G, Karthikeyan G, Sharma S, et al. Carotid intima-medial thickness as a marker of disease activity in Takayasu's arteritis. Int J Cardiol. 2006;108:385-90. [ Links ]
82. Nienhuis HL, de Leeuw K, Smit AJ, Bijzet J, Stegeman CA, Kallenberg CG, et al. Enhanced endothelium-dependent microvascular responses in patients with Wegener's granulomatosis. J Rheumatol. 2007;34:1875-81. [ Links ]
83. De Leeuw K, Sanders JS, Stegeman CA, Smit A, Kallenberg CG, Bijl M. Accelerated atherosclerosis in patients with Wegener's granulomatosis. Ann Rheum Dis. 2005;64:75-59. [ Links ]
84. Hafner F, Haas E, Belaj K, Froehlich H, Gary T, Eller P, et al. Endothelial function and carotid intima-media thickness in giant-cell arteritis. Eur J Clin Invest. 2014;44:249-56. [ Links ]











 texto em
texto em