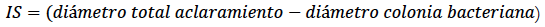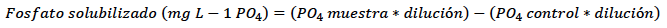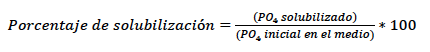Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Ciencia y Tecnología Agropecuaria
versão impressa ISSN 0122-8706versão On-line ISSN 2500-5308
Cienc. Tecnol. Agropecuaria vol.22 no.2 Mosquera maio/ago. 2021 Epub 01-Maio-2021
https://doi.org/10.21930/rcta.vol22_num2_art:1897
Recursos biofísicos
Solubilización de fosfatos por bacterias del género Burkholderia aisladas de oxisoles de la altillanura colombiana
1Corporación Colombiana de Investigación Agropecuaria (AGROSAVIA). CI La Libertad, Villavicencio
2Corporación Colombiana de Investigación Agropecuaria (AGROSAVIA). CI La Libertad, Villavicencio
3Corporación Colombiana de Investigación Agropecuaria (AGROSAVIA). CI Tibaitatá, Mosquera
Los oxisoles de la altillanura en Colombia contienen hasta 400 mg/kg de fósforo. Sin embargo, la fracción disponible para las plantas es inferior a 3,5 mg/kg, lo que obliga la suplementación con fertilizantes fosfóricos. Las plantas pueden adaptarse a estas condiciones por medio de interacciones con bacterias solubilizadoras de fosfatos (BSF) presentes en el suelo. Los oxisoles serían una potencial fuente de BSF; no obstante, existe un desconocimiento de su diversidad en la altillanura colombiana. El objetivo de esta investigación fue aislar, caracterizar e identificar BSF de oxisoles de la altillanura colombiana. A partir de muestras compuestas de suelo con cultivos transitorios y sabana, se obtuvieron 42 aislamientos. De estos, 14 cepas mostraron índices de solubilización de fosfatos entre 1,2 y 2,4. Las cepas M15 y M18 se seleccionaron por su alta actividad de las fosfatasas ácidas con 297,7 ± 89,6 y 638,3 ± 31,2 μg de p- nitrofenilfosfato/mL/h, respectivamente. Los dos aislamientos promovieron el crecimiento vegetal en plantas de arroz en condiciones de invernadero. Mediante la secuenciación parcial del gen 16S rRNA, las dos cepas fueron identificadas dentro del género Burkholderia.Esta investigación amplía el conocimiento de las BSF presentes en los oxisoles de la altillanura colombiana, así como sus capacidades para favorecer la disponibilidad de fósforo en el suelo y promover el crecimiento vegetal.
Palabras clave ciclos biogeoquímicos; ecología microbiana; fósforo; oxisol; rizosfera
Oxisols from the Colombian high plains contain up to 400 mg/kg of phosphorus; however, the fraction available to plants is less than 3.5 mg/kg, requiring supplementation with phosphoric fertilizers. Plants can adapt through interactions with soil phosphate solubilizing bacteria (PSB). Oxisols might be a source of PSB, but we ignore its diversity in the Colombian high plains. This research aims to characterize and identify PSB isolated from Oxisols from this region. By sampling soil from transitory crops and the savanna, we obtained 42 isolates. Fourteen strains showed phosphate solubilization indices from 1.2 to 2.4. We selected the M15 and M18 strains due to their high acid phosphatase activity with 297.7 ± 89.6 and 638.3 ± 31.2 μg of PNPP/mL/h, respectively. These two isolates promoted plant growth in greenhouse rice plants. Through the 16S rRNA gene sequence, we identified the two strains within the genus Burkholderia. This research extends the knowledge of the PSB nature-occurring in Oxisols from the Colombian high plains and their capabilities to favor phosphorus availability in soil and promote plant growth.
Keywords biogeochemical cycles; microbial ecology; oxisol; phosphorus; rhizosphere
Introducción
El fósforo (P) es un nutriente esencial para las plantas. Hace parte de moléculas como el ADN, ATP y RNA, e interviene en la biosíntesis de proteínas y ácidos grasos, la fotosíntesis, la glicolisis y la respiración, así como la división y multiplicación celular (Corrales-Ramírez et al., 2014; Krishnaraj & Dahale, 2014; Wyngaard et al., 2016). En suelos del trópico húmedo, la movilidad de este elemento es muy baja; solo un 4% está disponible como ortofosfatos, encontrándose iones monobásicos (H2PO4-1) y dibásicos (HPO4-2) requeridos por las plantas para su crecimiento (Zhu et al., 2018). Por otra parte, es posible hallar fosfatos de calcio como la fluorapatita, oxiapatita e hidroxiapatita que, por procesos de precipitación o fijación, son de difícil acceso para las especies vegetales, así como óxidos hidratados de hierro o aluminio que forman complejos insolubles con el P, no disponible en el suelo (Cerón & Aristizábal, 2012; Daneshgar et al., 2018). La baja disponibilidad de P afecta el crecimiento de las plantas y la productividad agrícola (Lynch, 2007; Satyaprakash et al., 2017), lo que obliga su incorporación a través del uso de fertilizantes de síntesis química en cada campaña de cultivo.
En Colombia, los suelos de la altillanura plana son, en su mayoría, del orden Oxisol (Tropeptic haplustox isohipertérmico) (Soil Survey Staff, 1999, 2014), y se caracterizan por bajos contenidos de nutrientes con porcentajes reducidos de materia orgánica (15.000 mg/kg a 30.000 mg/kg), altos contenidos de hierro y aluminio, y pH ácidos, entre 3,8 y 5,0 (Rivas et al., 2004). Esto hace que el P sea poco disponible para las plantas y que, a pesar de estar presente en concentraciones entre 200 y 430 mg/kg, se encuentre mayoritariamente fijado por las condiciones de acidez.
Dada esta condición, las plantas han desarrollado estrategias adaptativas a nivel radicular como las modificaciones morfológicas con la dispersión de raíces laterales, la producción de exudados radicales o la interacción con BSF, que favorecen la biodisponibilidad de este elemento en el suelo (Mehta et al., 2015; Richardson et al., 2011). La interacción entre BSF y raíces juega un papel clave en la movilidad y ciclo del P en muchos agroecosistemas, particularmente del trópico (Gumiere et al., 2019; Liang et al., 2020).
Bacterias de los géneros Achromobacter, Aerobacter, Arthrobacter, Azospirillum, Azotobacter, Bacillus, Burkholderia, Erwinia, Escherichia, Flavobacterium, Gluconacetobacter, Micrococcus, Pantoea, Pseudomonas. Rhizobium han sido reportadas por su capacidad para solubilizar fosfatos que, por procesos de fijación, no están disponibles en los suelos ácidos. Algunas de ellas están asociadas a la rizosfera de cultivos como el maíz y el arroz (Corrales-Ramírez et al., 2014; Sandanakirouchenane et al., 2017). Entre los mecanismos empleados por estos microorganismos para la solubilización está la disminución del pH del suelo, mediada por la producción de ácidos orgánicos de bajo peso molecular como el ácido butírico, succínico, oxálico, málico, glucónico, acético, láctico, cítrico y fumárico (Mehta et al., 2015; Stephen & Jisha, 2011). Por otro lado, la producción de fosfatasas ácidas, fosfatasas alcalinas, lipasas y fitasas también contribuye a la disponibilidad de fosfatos en el suelo mediante la mineralización del P orgánico (Billah et al., 2019; Othman & Panhwar, 2014).
Teniendo en cuenta que en la rizosfera se pueden encontrar diversos géneros de microorganismos solubilizadores de fosfatos naturalmente adaptados a ambientes locales, y dada la condición de baja disponibilidad de este elemento para las plantas, el objetivo de esta investigación fue aislar, caracterizar e identificar bacterias rizosféricas solubilizadoras de fosfatos de oxisoles de la altillanura plana colombiana y evaluar su potencial para promover el crecimiento vegetal bajo condiciones de invernadero.
Materiales y métodos
Muestreo y aislamiento de microorganismos solubilizadores de fosfatos
Se colectaron diez muestras compuestas, cada una conformada por cuatro submuestras previamente homogeneizadas, de la rizósfera de maíz (Zea mays), soya (Glycine max), arroz (Oryza sativa) y la pastura Brachiaria sp. presente en una sabana, cuyo suelo fue mejorado con la aplicación de enmiendas, fertilizantes y rotación de cultivos en diferentes puntos de la altillanura plana colombiana, en el transecto Puerto López - Puerto Gaitán (04 °09' 42.231", -72° 49' 39.669"; 04° 20' 38.9754", -72° 01' 9.156"), en el departamento del Meta. Para el aislamiento de bacterias rizosféricas asociadas a cada especie vegetal, se seleccionaron dos lotes establecidos con maíz, dos con arroz, dos con soya y uno con la pastura.
A las muestras compuestas se les determinó el pH, la cantidad de P disponible por Bray II (Bray & Kurtz, 1945) y el porcentaje de materia orgánica por el método de Walkley y Black (1934) con modificaciones. Para el conteo de unidades formadoras de colonias (UFC) y el aislamiento de bacterias solubilizadoras de fosfatos, se pesaron 10 g de rizosfera con fragmentos de raíces de las muestras compuestas de cada punto de muestreo, y se adicionó en 90 mL de medio de cultivo líquido SMRS con modificaciones (g/L): glucosa, 10; Ca3(PO4)2, 5; (NH4)2SO4, 0,5; NaCl, 0,2; MgSO47H2O, 0,3; KCL, 0,2; MnSO4H2O, 0,004; FeSO47H2O, 0,002); pH: 7,0 ± 0,2 (Sundara & Sinha, 1963, citado por Suliasih & Widawati, 2005). Se dejó en agitación constante por 24 h a 200 rpm en un agitador orbital (Lab-Line instruments Inc, modelo 3520, USA).
A partir de cada muestra, se realizaron diluciones seriadas hasta 10-6 en solución salina estéril al 0,85% (p/v). Se sembró una alícuota de 100 µL de cada dilución en medio de cultivo Pikovskaya (Pikovskaya, 1948) (g/L): glucosa, 10; Ca3(PO4)2, 5; (NH4)2SO4, 0,5; NaCl, 0,2; MgSO47H2O, 0,1; KCL, 0,2; extracto de levadura, 0,5; MnSO4H2O, 0,002; FeSO47H2O, 0,002; agar-agar, 15, pH: 7,0 ± 0,2 y medio de cultivo SMRS, suplementado con roca fosfórica (RF) (5 g/L), con adición de púrpura de bromocresol como indicador de pH. Las cajas Petri con los medios citados se incubaron por cinco días a 28 °C ± 2 °C hasta observar el crecimiento de colonias con halos que acidificaron el medio evidenciado por un cambio de color. Las cepas seleccionadas se caracterizaron microscópicamente y se conservaron en glicerol al 20% a -20 °C, hasta su posterior evaluación e identificación molecular.
Caracterización de los aislamientos como potenciales solubilizadoras de fosfatos
Determinación del índice de solubilización (IS)
Las 42 cepas aisladas se sembraron en caja Petri con medio de cultivo SMRS suplementado con roca fosfórica (RF) (5 g/L), y SMRS con fosfato tricálcico (FT) (5 g/L) como única fuente de P. En cada medio de cultivo se colocaron tres anillos de plástico (diámetro: 0,5 cm) esterilizados y se inocularon 30 µL de una suspensión celular (concentración 108 UFC/mL) de cada cepa. Se incubaron por 24 a 48 h a temperatura de 28 °C ± 2 °C hasta observar la formación de halos alrededor del anillo (Chakraborty et al., 2010). La medida del diámetro de la colonia y del halo de hidrolisis en el medio de cultivo se realizó con ayuda de un decímetro. Se establecieron tres replicas biológicas por triplicado a través del tiempo, y con las mediciones obtenidas, se determinó el índice de solubilización (IS) como criterio para la selección de cepas promisorias, siguiendo la ecuación propuesta por Awais et al. (2017):
Los datos fueron analizados estadísticamente utilizando el programa SAS, versión 9,3 (SAS Institute, USA), mediante un análisis de varianza empleando la prueba de Tukey (α = 0,05) para la determinación de diferencias estadísticamente significativas entre las medias de los tratamientos evaluados (fuente de fósforo vs. cepas).
Determinación de la actividad fosfatasas ácidas
Se empleó la metodología propuesta por Tabatabai y Bremner (1969), usando como sustrato colorimétrico .-nitrofenilfosfato (PNPP 0,025 M). Adicionalmente, se evaluó la evolución del pH en el medio de cultivo como indicador de la producción de ácidos orgánicos. Las cepas bacterianas se cultivaron en medio Pikovskaya (PVK) (Pikovskaya, 1948) y se dejaron en agitación constante a 180 rpm durante nueve días, con una temperatura de 28 °C ± 0,5 °C (Incubador Heidolph 1000, Heidolph Co., Alemania). Después del tercer, sexto y noveno día de incubación, se tomaron alícuotas de 5 mL de medio de cultivo y se determinó el pH (Hanna Hi8314, Hanna Instruments, Alemania). Adicionalmente, se obtuvieron muestras de sobrenadante sin células bacterianas (muestra control) mediante centrifugación de 2 mL de cultivo a 24.400 xg, a 20 °C ± 0,5 °C, durante 10 min (Centrifuga Rotina 420 Hettich 4701- 01, Hettich GmbH & Co., Alemania).
Pasado este tiempo, se agregaron 2 mL de tampón universal modificado al 0,5 M (MUB, pH 6,5) y 0,5 mL del sustrato (PNPP 0,025 M) a 1 mL de medio sobrenadante de PVK. Las reacciones se llevaron a cabo a 37 °C ± 1 °C, durante 60 min, y se detuvieron agregando 1 mL de CaCl2 0,5 M y 4 mL de NaOH 0,5 M. Las muestras se filtraron con papel de filtro (grado 401 cualitativo, VWR, Cat 5160282), con tamaño de poro de 12-15 µm. El p-nitrofenol (PNP) formado se midió en un espectrofotómetro (Optizen POP UV-Vis, Mecasys, Corea del Sur) a 400 nm. Se evaluaron tres réplicas independientes por cada cepa. Los controles fueron analizados bajo las mismas condiciones experimentales. La actividad enzimática (U) se definió como microgramos de PNP liberado por mililitro por hora (µg/mL/h) (Barrera et al., 2019).
Determinación del porcentaje de solubilización de fosfatos
Se empleó el método de fosfomolibdeno por medio la prueba analítica de Spectro Quant® Fósforo (Merck KGaA, Darmstadt, Alemania) para la determinación del porcentaje de solubilización (Murphy & Riley, 1962, citado por Ortiz et al., 2016). De cada cepa sembrada en SMRS, se tomaron 10 mL del medio con una concentración de 108 y se diluyeron en 90 mL de solución salina al 0,85% (p/v). Posteriormente, se inoculó por triplicado, 2 mL de cada dilución en 100 mL de medio de cultivo líquido NBRIP (Nacional Botanical Research Institute Phosphate growth medium) (g/L): glucosa, 10; Ca3 (PO4)2, 5; MgCl26H2O, 5; (NH4)2SO4, 0,1; NaCl, 0,2; MgSO47H2O, 0,25; KCL, 0,2; pH: 7,0 ± 0,2, descrito por Nautiyal (1999), suplementado con FT (5 g/L).
Como control positivo se utilizó un inóculo de Penicillium janthinellum (Cepa: FP010 - Colección del laboratorio de Bioinsumos del Instituto de Biotecnología de la Universidad Nacional de Colombia [IBUN]), hongo solubilizador de fosfatos empleado como ingrediente activo de un bioproducto para cultivos de arroz (Pineda, 2014), y como control negativo se utilizó el medio de cultivo sin inocular por triplicado. Se incubaron en agitación constante, a 150 rpm a 28 °C ± 2 °C, durante 10 días. Luego del tiempo de incubación, se homogenizó el caldo de fermentación y se tomaron 2 mL de muestra, que se centrifugaron a 11.200 xg durante 10 min a 20 ± 0,5 °C, hasta separar completamente la fracción soluble. Este sobrenadante traslucido se refrigeró a 4 °C ± 2 °C hasta el momento de la lectura de las muestras.
Para la determinación de la prueba cuantitativa, en un tubo Eppendorf se dispensaron 250 µL del sobrenadante (obtenido previamente); se adicionaron 750 µL de agua destilada y 240 µL del reactivo Spectro Quant® Fósforo (Merck, Alemania). Las muestras se agitaron en vortex (Genie®2, modelo G560 Scientific Industries Inc., USA); se dejaron en reposo por 10 min y se determinó la absorbancia en un espectrofotómetro (Optizen POP UV-Vis, Mecasys, Corea del Sur) a 450 nm. La cantidad de fosfato solubilizado por los microorganismos, expresada en mg/L y el porcentaje de solubilización, se determinó con las siguientes ecuaciones:
La determinación del porcentaje de solubilización se realizó una vez se obtuvieron las colonias puras de los microorganismos aislados (tiempo 0) y, posteriormente, se evaluó esta actividad a los seis meses después de conservado el material biológico a -20 °C (tiempo 1).
Determinación de compuestos indólicos
Se empleó el método colorimétrico basado en la reacción del reactivo de Salkowsky, descrito por Glickmann y Deessaux (1995) con modificaciones. Las cepas se cultivaron en medio NBRIP suplementado con triptófano (2 mg/L), se observó el viraje de color en el medio de cultivo bajo condiciones in vitro después de 30 min, y se hizo la lectura de absorbancia a 450 nm en el espectrofotómetro (Optizen POP UV-Vis, Mecasys, Corea del Sur). Las determinaciones se realizaron por triplicado para cada cepa evaluada.
Identificación molecular
La obtención del ADN de las cepas se realizó con un kit de extracción (GenElute™ Bacterial Genomic DNA Kits, Sigma Aldrich Co. LLC). La determinación de la pureza y la cuantificación se realizó en un espectrofotómetro NanoDrop® (ND-1000 UV-Vis Thermo Fisher Scientific, Alemania). Con el ADN extraído de las cepas M15 y M18 se realizó la PCR en un termociclador (PTC100 MJ Research® Global Medical Instrumentation, Inc., Minnesota, EE. UU.), con una concentración de 25 µg, empleando los primers universales 27F (5’ AGAGTTTGATCCTGGCTCAG 3’) y 1492R (5’ AGAAAGGAGGTGATCCAG CC 3’) para la amplificación del gen 16S rRNA. El producto amplificado se visualizó en un gel de agarosa al 2% previo a su secuenciación, y se envió a Macrogen Inc., (Seúl, Korea). Las secuencias obtenidas se editaron y se ensamblaron utilizando el software Geneious®, versión 9,8 (Biomatters Ltda, Auckland, Nueva Zelanda). Posteriormente, se analizaron con el algoritmo BLAST (http://blast.ncbi.nlm.nih.gov/) y el análisis taxonómico de las secuencias ensambladas se comparó con las bases de datos del RefSeq Genomic GenBank (National Center for Biotecnology Information [NCBI]), Grengenes (Laurence Berkeley National Laboratory, http://greengenes.lbl.gov/cgi-bin/nph-index.cgi) y RDP Versión 11 (Ribosomal Database Project, http://rdp.cme.msu.edu).
Pruebas de virulencia de cepas bacterianas
Las pruebas de virulencia de las cepas bacterianas identificadas se realizaron en Agar King B y en tejido vegetal de cebolla Allium cepa L. (Amaryllidaceae), utilizada como planta modelo (Leitão et al., 2010; Sinha et al., 2017), adaptando la metodología propuesta por Karki (2010). Las cepas se sembraron en medio de cultivo King B (g/L): peptona de carne, 10; peptona de caseína, 10; K2HPO4, 1,5; MgSO47H2O, 1,5; agar- agar, 15, pH: 7,0 ± 0,2 (King et al., 1954), para determinar la producción de pigmento difusible en el medio relacionado con la producción de fitotoxinas (Sinha et al., 2017). Posteriormente, se realizaron cortes de tejido de cebolla de aproximadamente 2 × 3 cm, previamente desinfectados con hipoclorito de sodio al 1%, y la inoculación se realizó con 10 µL de cada cepa, con concentraciones de 103, 105 y 108 UFC/mL. Se dejó en incubación a 30 °C ± 1 °C, haciendo monitoreo desde las 24 h hasta las 72 h. La prueba se consideró positiva cuando se evidenciaron síntomas de maceración del tejido y cambios de color, desde amarillo pálido hasta marrón, en el borde de la lesión, indicando la presencia de enzimas degradadoras.
Como control positivo se emplearon tres cepas de la colección de trabajo del Centro de Investigación La Libertad de Agrosavia, caracterizadas molecularmente como Burkholderia glumae (Kurita & Tabei, 1967), aisladas a partir de panículas sintomáticas de un cultivo de arroz establecido en la altillanura. Como control negativo se empleó la cepa B02, identificada molecularmente con un 99% de similitud como un Rhizobium sp. (GenBank número de accesión MK559029) (Amaya et al., 2020), perteneciente al Banco de Germoplasma de Agrosavia.
Evaluación de la promoción de crecimiento en plantas de arroz en condiciones de invernadero
Para evaluar el efecto de la actividad solubilizadora de fosfatos en las cepas seleccionadas y su relación con la promoción de crecimiento vegetal, se estableció un ensayo en materos con 3 kg de suelo (oxisol) sin esterilizar, proveniente de un lote sin manejo previo, con bajo contenido de P (2,52 mg/kg), pH: 4,9 y 6.800 mg/kg de materia orgánica. Se sembraron en cada matero dos semillas de arroz Oryza sativa L. (Poaceae., previamente desinfectadas con hipoclorito de sodio al 2% por 3 min y enjuagadas con agua destilada estéril. Las semillas antes de la siembra se embebieron con un inóculo de la cepa M15 y M18 individualmente y fueron coinoculadas con una concentración celular de 108 UFC/mL durante 30 min. Quince días después de germinado el material, se realizó una reinoculación en la rizosfera de cada planta, aplicando 2 mL del medio de cultivo PVK con cada una de las cepas con una concentración de 108 UFC/mL empleando una jeringa estéril. Las plantas control se inocularon con un medio de cultivo estéril.
Se evaluaron nueve tratamientos distribuidos en bloques completos al azar con seis repeticiones (T1: Testigo-Plantas control no inoculadas y sin fertilización con P; T2: Plantas inoculadas con la cepa M15 sin P; T3: Plantas inoculadas con la cepa M18 sin P; T4: Plantas coinoculadas con M15 y M18 sin P; T5: Plantas fertilizadas con 50% de P (60 kg/ha); T6: Plantas inoculadas con M15 más 50% de P; T7: Plantas inoculadas con M18 más 50% de P; T8: Plantas coinoculadas con M15 y M18 más 50% de P; T9: Plantas fertilizadas con 100% de P). Las cepas M15 y M18 fueron evaluadas previamente en pruebas de compatibilidad. La fertilización con P2O5 se realizó al momento de la siembra, utilizando superfosfato triple, y la cantidad de fertilizante se definió en función de los requerimientos del cultivo, siendo el 100% la dosis recomendada para el arroz establecido en suelos ácidos de la altillanura correspondiente a 120 kg/ha (Aristizábal et al., 2000).
Se realizó un muestreo destructivo en el estadio de floración del cultivo (escala BBCH 69) (Enz et al., 1998), tomando variables asociadas a crecimiento como biomasa seca foliar y radical, número y peso de panículas. Los datos se analizaron estadísticamente con el software SAS, versión 9,3 (SAS Institute, USA), mediante un análisis de varianza empleando la prueba de Tukey (α = 0,05) para la determinación de diferencias estadísticamente significativas entre los tratamientos.
Resultados
Aislamiento de microorganismos solubilizadores de fosfatos
Los oxisoles presentaron rangos de pH entre 4,40 y 5,90, con un contenido de P disponible menor a 3,51 mg/kg y materia orgánica entre 13.600 mg/kg a 21.000 mg/kg. Por otra parte, al realizar el recuento de UFC de BSF en los suelos agrícolas y la sabana, se obtuvo un conteo de 4,3 × 106 UFC/g de suelo en la rizósfera de la soya, seguido por el maíz, el arroz y el pasto Brachiaria sp., con valores de 4,0, 2,6 y 1,2 x 106 UFC/g de suelo, respectivamente. Se obtuvieron 42 aislamientos descritos microscópicamente como bacterias Gram negativas.
Determinación del Índice de Solubilización (IS)
De las 42 cepas bacterianas aisladas de suelos de la altillanura, se seleccionaron 14 por presentar índices de solubilización (IS) entre 1,2 y 2,4, solubilizando la RF y el FT en el medio de cultivo SMRS. Tres cepas fueron seleccionadas a partir de la rizosfera de soya, cuatro de la rizosfera de maíz, cinco cepas aisladas de la rizosfera de arroz y dos aisladas de la rizosfera del pasto Brachiaria sp. presente en la sabana.
Los valores más altos para el IS se observaron en las cepas M1, M15, M20, M22, M27, M3, M8, M13, M7, evidenciándose diferencias estadísticamente significativas con respecto a M18, M23, M25, M26 y M28 (F13, 41 = 9,68; p < 0,001, Tukey α = 0,05) (tabla 1). Cuando las cepas fueron inoculadas en el medio de cultivo SMRS con FT, se pudo observar que M23 y M27 no formaron halo de solubilización después de 24 h de incubación, comparadas con las demás cepas que solubilizaron esta fuente de P en el medio.
Tabla 1. Índices de solubilización determinados en las cepas seleccionadas en medio de cultivo SMRS suplementado con roca fosfórica y fosfato tricálcico

Nota.Medias con letras diferentes sobre las barras indican diferencias estadísticamente significativas según la prueba de Tukey (α = 0,05); ND: no determinado; ± error estándar.
Fuente: Elaboración propia
Determinación de la actividad fosfatasa ácida
Se encontró un efecto significativo relacionado con el día de muestreo (F 2, 98 = 38; p < 0,001) y la identidad de la cepa (F 2, 98 = 46,95; p < 0,001). Al tercer y sexto día de incubación, las cepas M15, M18 y M23 mostraron la mayor actividad fosfatasa ácida con valores de 297,7 ± 89,6, 638,3 ± 31,2 y 666,7 ± 26,9 µg de PNPP/mL/h, respectivamente (Chi2 = 31,20; df = 10; p = 0,00054), observándose diferencias estadísticamente significativas comparadas con las demás cepas estudiadas (Chi2 = 30,36; df = 10; p < 0,001). A los nueve días de evaluación, las tres cepas disminuyeron su capacidad de producir fosfatasas ácidas (Chi2 = 31,09; df = 10; p = 0,00056). Para el caso de las cepas M1, M7, M25 y M26, estas no presentaron actividad fosfatasas ácidas en el medio de cultivo (figura 1).
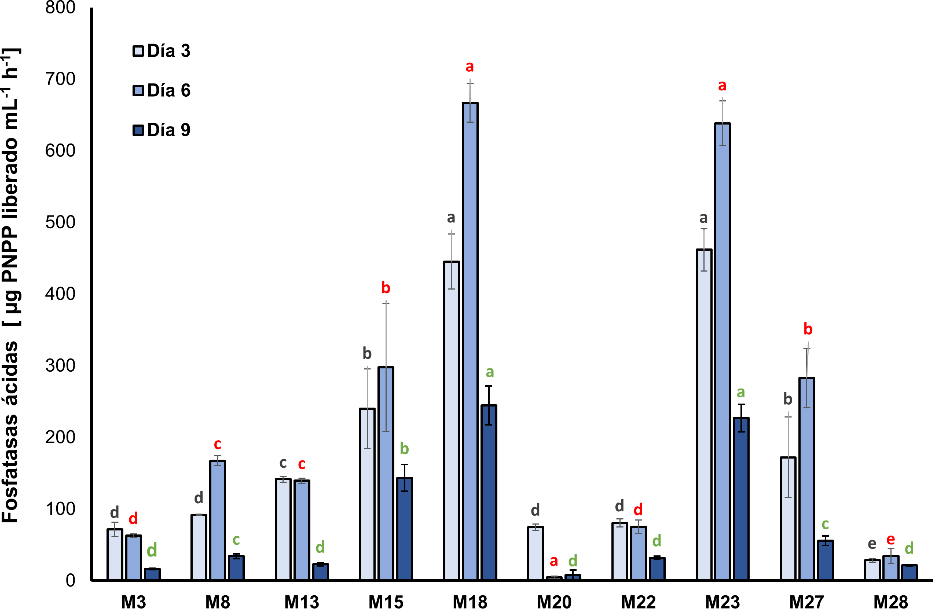
Fuente: Elaboración propia
Figura 1. Actividad de la enzima fosfatasa ácida determinada en cepas bacterianas sembradas en el medio de cultivo Pikovskaya (PVK) (media ± desviación estándar, n = 3); medias con letras diferentes sobre las barras indican diferencias estadísticamente significativas según la prueba de Tukey (α = 0,05). La comparación entre aislamientos se realizó agrupando tiempos de muestreo.
En la figura 2 se observa cómo el pH en el medio de cultivo PVK disminuyó junto con el tiempo de incubación del cultivo (F 2, 98 = 1,049; p = 0,0002). Después de tres días de incubación, las cepas M15, M20 y M22 mostraron una acidificación significativa en el medio de cultivo, pasando de pH 7,0 (inicial) a 3,90 ± 0,09, 3,85 ± 0,19 y 3,61 ± 0,32 respectivamente (Chi2 = 30,131 df = 10; p = 0,00081).
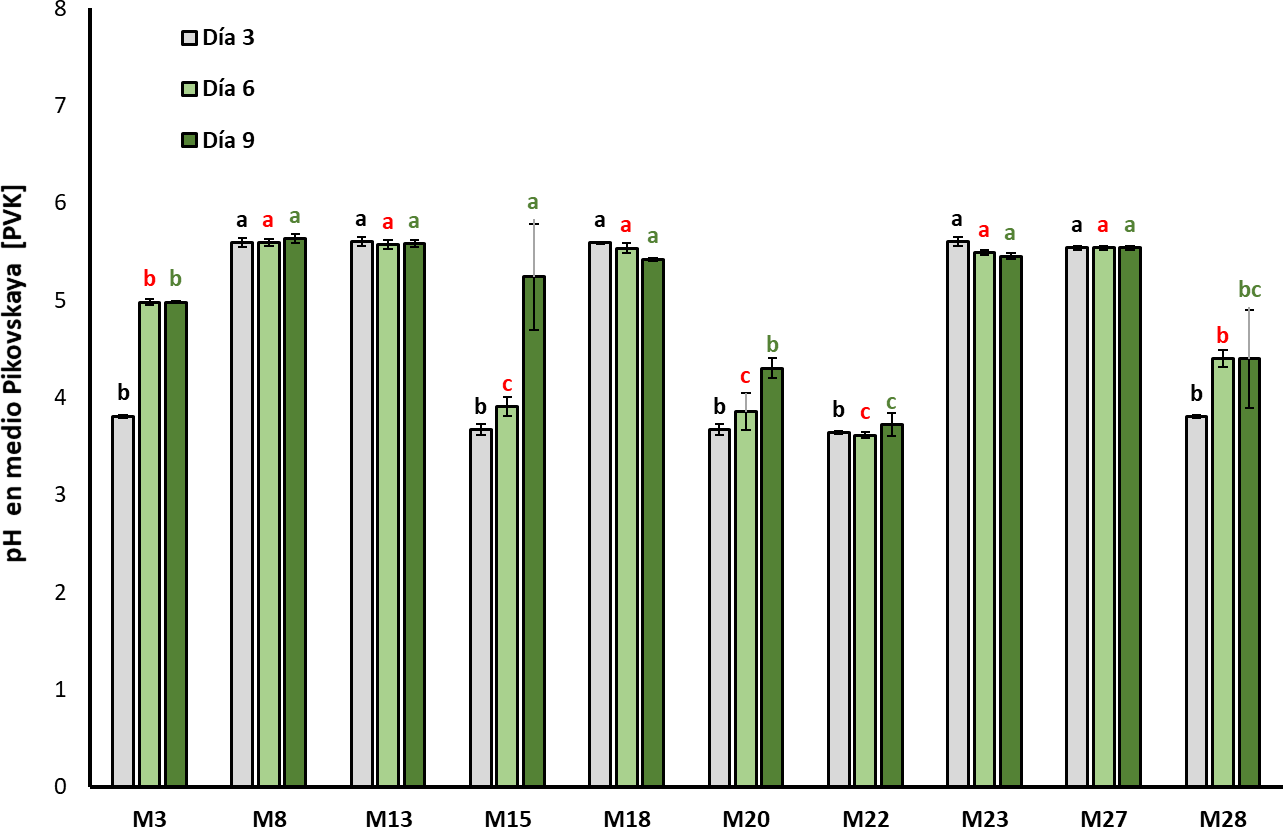
Fuente: Elaboración propia
Figura 2. Evolución del pH en el medio de cultivo Pikovskaya (PVK) durante el crecimiento de las bacterianas (media ± desviación estándar, n = 3); medias con letras diferentes sobre las barras indican diferencias estadísticamente significativas según la prueba de Tukey (α = 0,05). La comparación entre aislamientos se realizó agrupando tiempos de muestreo.
Determinación del porcentaje de solubilización de fosfatos
Las cepas M15 y M18 mostraron una mayor significancia en su capacidad para liberar PO43- en el medio (F 13, 41 = 58,04; p < 0,001, Tukey HSD α = 0,05), presentando una eficiencia del 47% en la solubilización de fosfatos bajo condiciones in vitro, con valores de 1.460 y 1.458 mg/L, respectivamente, similar al control positivo (Penicillium jantinellum) (figura 3). La actividad solubilizadora de fosfatos observada en las cepas M15 y M18 se mantuvo después de seis meses de conservación a -20 °C, con valores similares a los obtenidos en el tiempo 0; caso contrario se observó con los demás aislamientos cuya capacidad no fue detectable después de este tiempo de almacenamiento. Para la cepa M28 se evidenció una baja producción de fosfatasas ácidas en los tiempos evaluados, por lo cual se excluyó de las evaluaciones posteriores.
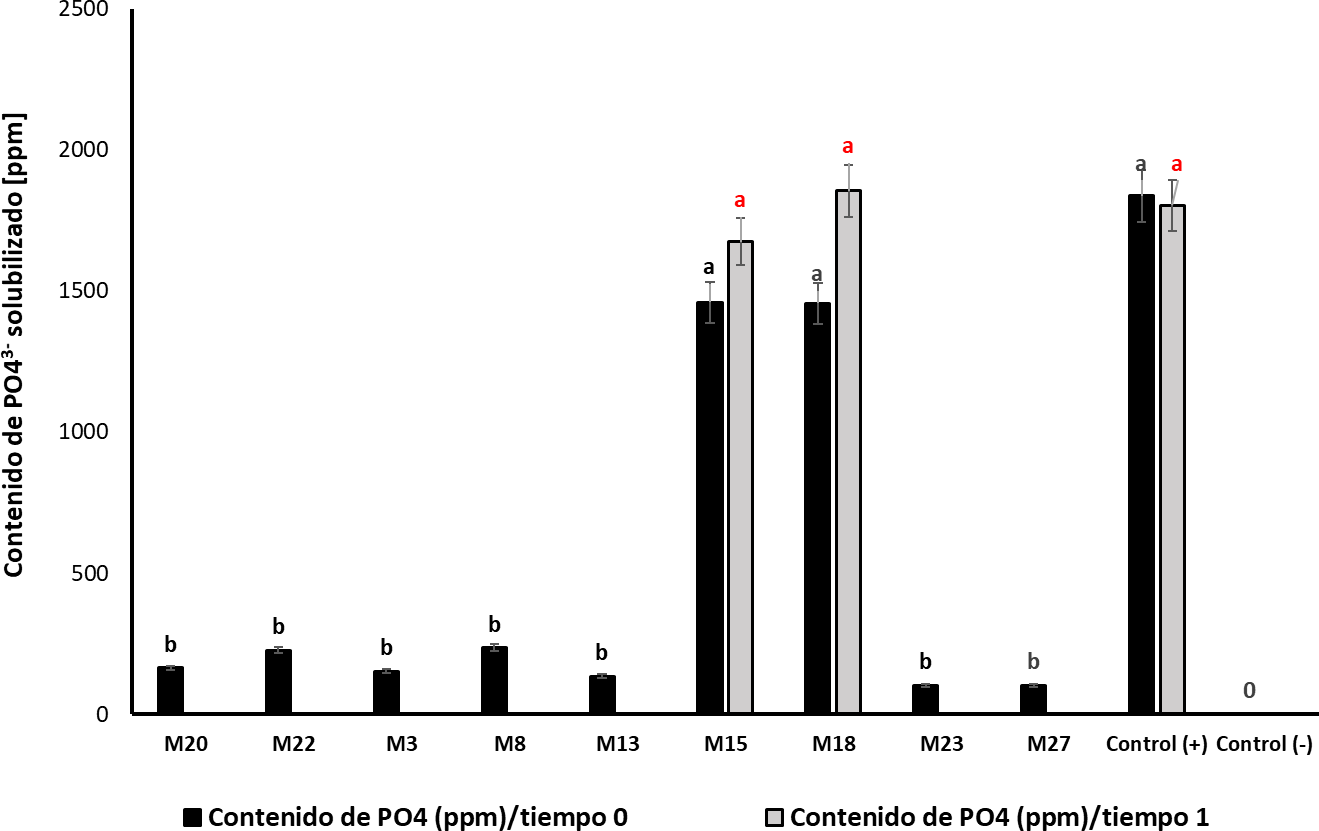
Fuente: Elaboración propia
Figura 3. Contenido de PO43 solubilizado por las cepas seleccionadas como potenciales solubilizadores de fosfatos Tiempo 0 colonias puras de los microorganismos aislados Tiempo 1 evaluación de la actividad a los seis meses de conservado el material biológico a 20 °C media ± desviación estándar n = 3 medias con letras diferentes sobre las barras indican diferencias estadísticamente significativas según la prueba de Tukey α 005
Determinación de compuestos indólicos
En cuanto a la determinación de compuestos indólicos, las cepas M15 y M18 mostraron producciones de 0,229 y 0,05 mg/L, respectivamente.
Identificación molecular de las cepas
Teniendo en cuenta los resultados anteriores, la investigación continuó con la identificación de las cepas promisorias M15 y M18 seleccionadas por la producción de fosfatasas ácidas y solubilización de P en el medio de cultivo in vitro. Los análisis taxonómicos de la secuencia del 16S rRNA ensamblada, comparada con la base de datos nr/nt del NCBI y Greengenes, indicaron que la cepa M15 presentó un 99,1% de identidad en el 100% de su longitud, con secuencias del gen ribosomal 16S, pertenecientes a Burkholderia ubonensis (GenBank número de accesión MN935186.1); para el caso de la cepa M18, se pudo identificar como perteneciente al complejo de Burkholderia cepacia (Bcc) (GenBank número de accesión MN935187.1).
Pruebas de virulencia de cepas bacterianas
Los resultados de la identificación molecular de M15 (Burkholderia ubonensis) y M18 (Burkholderia cepacia) permitieron evaluar dos factores de virulencia a nivel in vitro. En los ensayos realizados con las dos cepas mencionadas, no se observó la presencia de pigmentos difusibles asociados a la producción de toxoflavina en el medio de cultivo King B durante los tiempos evaluados comparados con los controles positivos (figura 4).
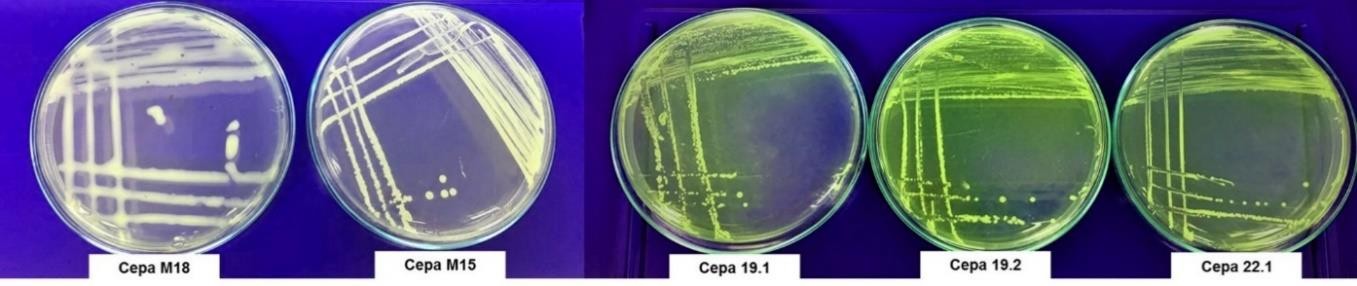
Fuente: Elaboración propia
Figura 4. Evaluación de la producción de pigmento difusible en el medio de cultivo King B. De izquierda a derecha: M18 (B. cepacia) y M15 (B. ubonensis). Controles positivos de B. glumae: 19,1; 19,2; 22,1.
Los resultados en bulbos de cebolla mostraron que las concentraciones de 103 y 105 UFC/mL, empleadas en las inoculaciones con las cepas M15 (B. ubonensis) y M18 (B. cepacia), no ocasionaron daños en el tejido vegetal. Sin embargo, la cepa M15 (B. ubonensis), inoculada a una concentración de 108 UFC/mL, generó una lesión en el sitio de la punción, evidenciada por un cambio de color en el tejido, indicando la presencia de enzimas degradadoras. Asimismo, este cambio fue observado en los bulbos inoculados con los controles positivos (B. glumae) a esa misma concentración. Por otra parte, no se evidenciaron síntomas en el tejido de la cebolla inoculado con la cepa M18 (B. cepacia) bajo las tres concentraciones celulares evaluadas. Aunque fueron reconocidas las lesiones en los bulbos de cebolla con la cepa M15 (B. ubonensis), es importante mencionar que, a la máxima concentración valorada en los diferentes ensayos realizados en este estudio, fue donde se evidenció su mayor capacidad para la producción de fosfatasas ácidas, enzimas encargadas de mineralizar el P orgánico del suelo.
Evaluación de la promoción de crecimiento en plantas de arroz en condiciones de invernadero
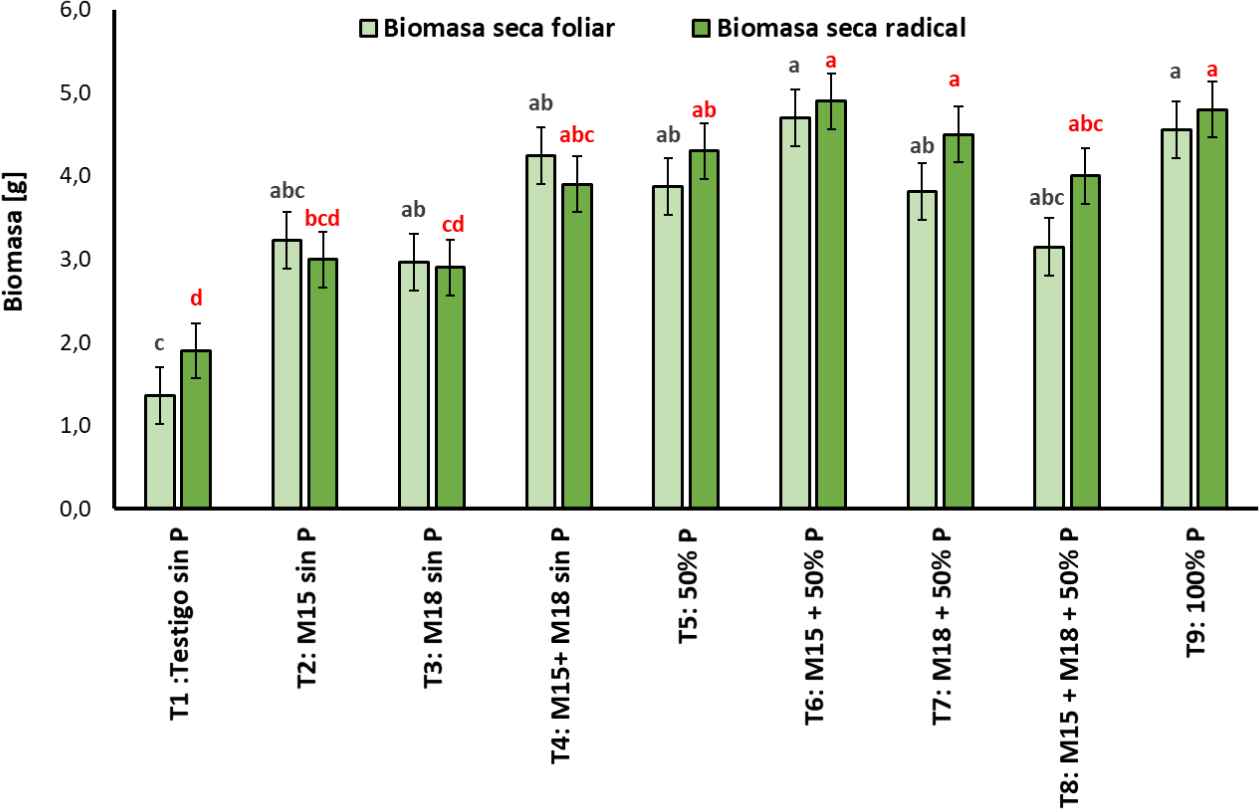
Fuente: Elaboración propia
Figura 5. Biomasa seca foliar y radical (g) tomada en plantas de arroz inoculadas con las cepas M15 (B. ubonensis) y M18 (B. cepacia) en etapa de floración (media ± desviación estándar, n = 6); medias con letras diferentes sobre las barras indican diferencias estadísticamente significativas según la prueba de Tukey (α = 0,05).
Es importante resaltar la tendencia observada en los tratamientos inoculados con las cepas y que no fueron fertilizados, en donde no se evidenciaron diferencias estadísticamente significativas comparadas con el tratamiento químico fertilizado con la dosis de P al 100%. En el tratamiento T4, en el que el arroz se coinoculó con M15-M18 y no se fertilizó, las plantas alcanzaron una producción de biomasa estadísticamente similar al tratamiento T9, en donde las plantas se fertilizaron con un 100% de la dosis de P recomendada para esta especie vegetal, evidenciándose la función que cumplieron las bacterias solubilizadoras en el suelo con baja disponibilidad de este elemento, haciendo más eficiente su adquisición.
Con respecto a la biomasa seca radical, se evidenció que el tratamiento T1 (testigo) mostró el valor más bajo para esta variable con 2,0 g ± 0,1 g, asociado a un limitado desarrollo radical de las plantas, como consecuencia de la baja disponibilidad de P en el suelo, presentando diferencias estadísticamente significativas con respecto a los tratamientos T4, T5, T6, T7, T8 y T9, donde el peso de la biomasa fue similar, con valores entre 4,0 g ± 0,3 g y 5,0 g ± 0,3 g.
En relación con el número de panículas, se observó un mayor número de estructuras en el tratamiento T4, donde se realizó la coinoculación bacteriana a las plantas y no se fertilizó con P, seguido por los tratamientos T6, T7, T8 y T9. En cuanto al peso de las panículas, se evidenció que los tratamientos T6, T7, T8 y T9 mostraron los valores más altos para esta variable con 2,23 g ± 0,2 g, 2,27 g ± 0,03 g, 2,10 g ± 0,02 y 2,10 g ± 0,1 g, respectivamente, correspondientes al peso de los granos en formación, comparados con los demás tratamientos, donde el rango estuvo comprendido entre 0,95 g ± 0,05 g a 1,9 g ± 0,1 g (figura 6).
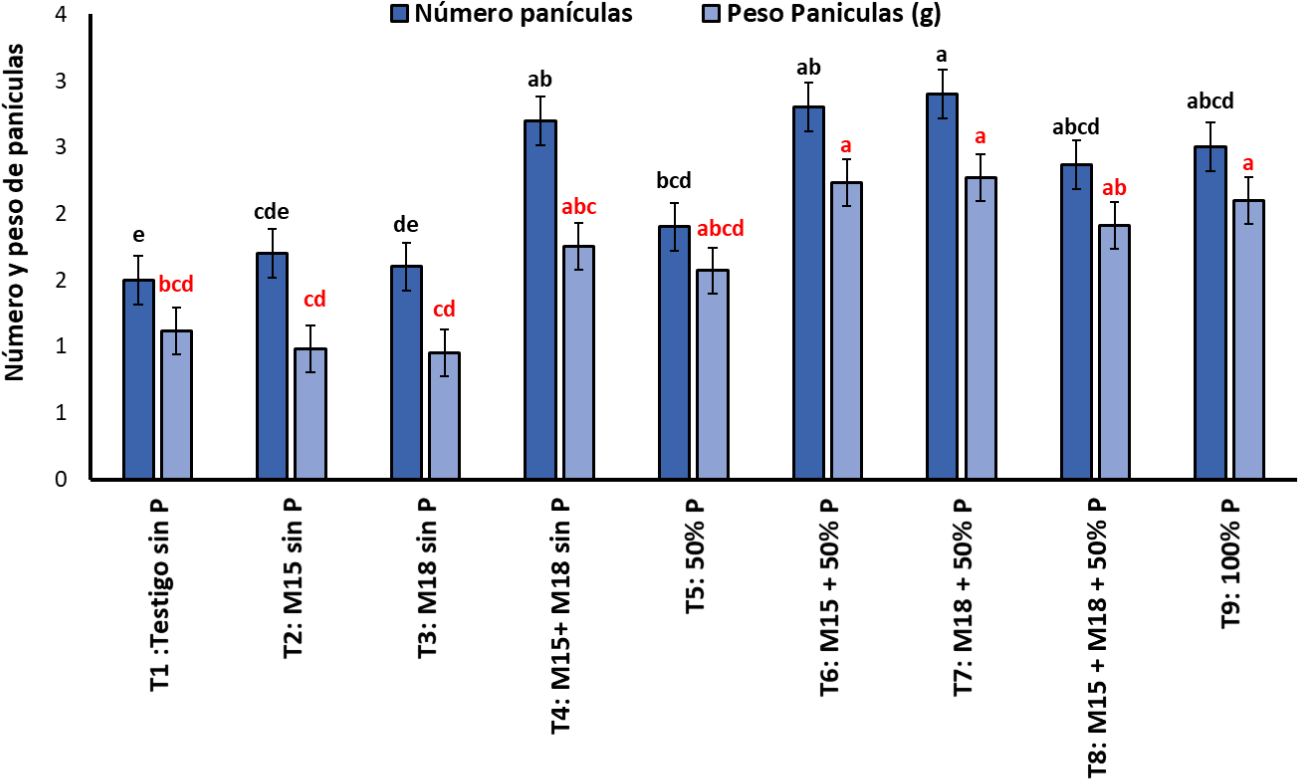
Fuente: Elaboración propia
Figura 6. Número y peso de panículas en plantas de arroz inoculadas con las cepas M15 (B. ubonensis) y M18 (B. cepacia) muestreadas en etapa de floración (media ± desviación estándar, n = 6); medias con letras diferentes sobre las barras indican diferencias estadísticamente significativas según la prueba de Tukey (α = 0,05)
Discusión
La deficiencia de P es la mayor limitante para el crecimiento de los cultivos en los oxisoles tropicales (Fageria & Baligar, 2008). La presencia de BSF en la rizosfera que permita la disponibilidad de este nutriente para las plantas reduciría el uso de fertilizantes de síntesis química en cultivos como el maíz, la soya y el arroz de importancia para la altillanura. Es importante anotar que la concentración de las poblaciones de BSF es influenciada por factores como el tipo de vegetación/cultivar, pH, los exudados radiculares, las prácticas de manejo, la actividad microbiana, la aplicación de fertilizantes y las condiciones ambientales locales, como temperatura y humedad (Rooney & Clipson, 2009). Es así como en este estudio se seleccionaron 14 cepas bacterianas a partir de oxisoles de diversas locaciones, que evaluadas bajo condiciones in vitro mostraron un potencial en la solubilización de fosfatos.
La cantidad de BSF encontradas en este estudio estuvo en el rango reportado por Caballero et al. (2007), quienes evidenciaron que, en suelos de sabana, arvenses y cultivados con soya en la misma zona de estudio, los conteos de BSF variaron entre 9,6 × 105, 2,5 × 105 y 7,6 × 106 UFC/g suelo, respectivamente, y a lo descrito por Bhardwaj et al. (2017) en suelos cultivados con coliflor (Brassica oleracea var. botrytis L.) con poblaciones de 1,3 × 106 y 2,2 × 106 UFC/g suelo. En contraste, se evidenciaron conteos mayores a los reportados por Becerra et al. (2011) para suelos de zonas productoras de uchuva (2,9 × 104 y 3,6 × 105 UFC/g suelo) en el departamento de Cundinamarca (Colombia).
Con respecto a los valores de IS, los indicadores para las cepas seleccionadas en este estudio son similares a los presentados por Collavino et al. (2010), quienes para bacterias rizosféricas aisladas de ultisoles en Argentina, de los géneros Acinetobacter, Burkholderia, Enterobacter, Exiguobacterium, Pantoea y Pseudomonas, determinaron IS entre 1,1 y 2,7, empleando FT como fuente de P. Los resultados también son comparables con los reportados por Motamedi et al. (2016) con bacterias Gram negativas de suelos cultivados con repollo, con IS entre 1,3 y 4,7. Por otra parte, Alam et al. (2002) evaluaron bacterias aisladas de la rizosfera de maíz, bajo condiciones in vitro, encontrando que el IS osciló entre 1,2 y 6,3 a las 24 h de incubación, incrementándose el halo de solubilización con el aumento del diámetro de la colonia después de siete días de evaluación. Otros estudios seleccionaron microorganismos solubilizadores de fosfatos de la rizosfera de arroz basados en el IS y cambios en el pH del medio, observando valores que oscilaron en un rango entre 2,1 a 6,2 a las 24 h de incubación, con pH que pasaron de 5,96 a 2,75 (Rashid et al., 2004).
La presencia de halo alrededor del anillo formado por las bacterias evaluadas bajo condiciones in vitro estaría principalmente asociado con la producción de ácidos orgánicos. Esto se evidenció con el cambio de color en el medio de cultivo suplementado con la fuente de P insoluble, que pasó de purpura a amarillo como resultado de la acidificación (Bashan et al., 2013). Esta condición puede variar a través del tiempo y es considerado como un criterio para la selección de BSF (Chung et al., 2005; Puente et al., 2004).
En cuanto a la producción de fosfatasas ácidas, las cepas M15 (B. ubonensis) y M18 (B. cepacia) mostraron actividades altas, comparadas con los reportadas por Oliveira et al. (2009), para Burkholderia y Pantoea, aisladas de la rizosfera de maíz, con producción de 3,57 y 50,2 µg de PNPP/mL/h, respectivamente. Además, son iguales a las reportadas por Acosta-Martínez et al. (2007) para bacterias que presentaron valores de 498,6 µg de PNPP/g/h. Otros estudios realizados con oxisoles de la amazonia del Brasil demostraron que la actividad fosfatasa en suelos puede llegar a valores cercanos a 700 µg de PNPP/g/h (Soltangheisi et al., 2019).
Los valores de PO43− mayores a 1.400 mg/L y una eficiencia del 47% en la solubilización de fosfatos indican que las cepas aisladas de oxisoles colombianos tienen un alto potencial en la solubilización de fosfatos. Resultados contrastantes fueron presentados por Pérez et al. (2007), quienes obtuvieron bacterias de los géneros Burkholderia, Serratia, Ralstonia y Pantoeaa partir de ultisoles venezolanos que mostraron rangos de solubilización entre 188 y 375 mg/L bajo condiciones in vitro, empleando FT como fuente de P. En particular, otros estudios determinaron bacterias del género Burkholderia anthinaen y Pantoea agglomerans con capacidades de solubilización de 600 mg/L a las 48 h de incubación (Walpola & Yoon, 2013). Igualmente, Oliveira et al. (2009) aislaron microorganismos potenciales en la solubilización de fosfatos, de la rizosfera de maíz en Brasil, y evidenciaron que Bacillus y Burkholderia fueron los géneros predominantes y más efectivos, solubilizando el 67% y 59% del P total, respectivamente, después de diez días de evaluación. Asimismo, bacterias de los géneros Klebsiella y Burkholderia, aisladas a partir de la rizosfera de caña de azúcar, mostraron porcentajes de solubilización que varió entre 41% y 63% sembrados en medio NBRIP suplementado con FT (Dar et al., 2014).
Las cepas M15 (B. ubonensis) y M18 (B. cepacia) seleccionadas como BSF produjeron cantidades bajas de compuestos indólicos comparadas con otras cepas de Burkholderia, que han sido reportadas como productoras de este tipo de compuestos empleando la misma metodología para esta determinación. Tal es el caso de Burkholderia heleia PAK1-2 con rendimientos cercanos a 100 µM y capacidad para inhibir patógenos como Burkholderia plantarii (Wang et al., 2016), y Burkholderia pyrrocinia con un máximo de producción de compuestos indólicos de 6,9 mg/L después de 36 horas de cultivo in vitro (Liu et al., 2019). En otros estudios con bacterias aisladas a partir de la rizosfera de mango Mangifera indica L. (Anacardiaceae) reportaron la producción de 2 ± 0,2 mg/L de compuestos indólicos para Burkholderia caribensis (De los Santos-Villalobos et al., 2015). Panhwar et al. (2012) encontraron que BSF en suelos cultivados con arroz secano en Malasia presentaron rangos entre 0,74 y 4,34 mg/L de producción de compuestos indólicos. Por otra parte, Dawwam et al. (2013), en investigaciones similares, encontraron para bacterias procedentes de la rizosfera de batata (Ipomoea batatas) concentraciones de compuestos indólicos entre 0,6 y 10,73 mg/L en el medio de cultivo suplementado con triptófano. Dentro de los compuestos indólicos, la fitohormona más importante es el ácido indol acético (AIA), que puede ser producida por microorganismos rizosféricos y se encarga de regular procesos como la división celular, el alargamiento, la diferenciación y la formación de patrones en las plantas (Sahasrabudhe, 2011).
La presencia de Burkholderia sp. en oxisoles tropicales ha sido escasamente registrada; no obstante, Oliveira et al. (2009) identificaron la especie B. cepacia en la región de Sete Lagoas en Minas Gerais, Brasil, con potencial en la solubilización de fosfatos. El género Burkholderia, comprendido por más de 60 especies, habita una amplia gama de nichos ecológicos, dado su metabolismo versátil (Coenye & Vandamme, 2003; Sousa et al., 2011; Suárez-Moreno et al., 2012), encontrándose ampliamente distribuido en la rizosfera de diversos cultivos, y estableciendo diferentes tipos de interacciones con las plantas ya sea colonizando las raíces, los tallos o las hojas.
Este género de bacterias Gram negativas puede llevar a cabo procesos asociados a la promoción de crecimiento vegetal como la conversión de nitrógeno atmosférico a amonio mediante la fijación biológica del nitrógeno, la producción de fitohormonas como el AIA, la solubilización de fosfatos y el control de patógenos (Caballero-Mellado et al., 2004; Estrada-De los Santos et al., 2001; Suárez-Moreno et al., 2012; Zhao et al., 2014). Es así como a las bacterias de este grupo se les han catalogado características como potenciales promotores de crecimiento vegetal y bioinoculantes para la agricultura, en cultivos como maíz (Zhao et al., 2014), piña (Borges-Baldotto et al., 2010), tomate (Gao et al., 2015) y banano (Weber et al., 2007), entre otros.
Autores como Mora y Toro (2007) y Useche et al. (2004) reportaron especies del complejo B. cepacia (Bcc) por su habilidad para colonizar la rizosfera de arroz y el maíz, cultivos de interés económico en suelos ácidos venezolanos, así como en suelos oxisoles amazónicos colombianos, con demostrable actividad solubilizadora de fosfatos. Por otra parte, Ahmed y Shahab (2015) y Sashidhar y Podile (2010) encontraron que bacterias pertenecientes al género Burkholderia son más eficientes en la solubilización de fosfatos minerales, debido a la secreción al medio extracelular de ácidos orgánicos como mecanismos de solubilización.
Pese a que varias especies del género Burkholderia son conocidas por su participación en procesos de promoción de crecimiento vegetal, también incluye reportes como agentes causales de enfermedades en humanos, animales y plantas (Li et al., 2013; Sinha et al., 2017; Rojas-Rojas et al., 2019; Stoyanova et al., 2007). El resultado positivo observado con la cepa M15 (B. ubonensis) evidencia el fenómeno asociado al mecanismo de quorum sensing (Kwak et al., 2020; Venturi et al., 2004), indicando que la temperatura y la densidad poblacional fueron óptimas bajo las condiciones evaluadas, lo que sugiere la expresión fenotípica de los genes de virulencia de la cepa en el tejido vegetal de la cebolla, posiblemente por la acción de enzimas tipo lipasa producida extracelularmente, con características termosolubles y cuya acción se desconoce en plantas (Yang et al., 2016).
Adicionalmente, Stone et al. (2012) reportaron cepas aisladas en Australia de B. ubonensis con el inusual lipopolisacarido tipo B de Burkholderia pseudomallei, soportado con estudios moleculares que sugieren en B. ubonensis una alta diversidad de este factor de virulencia, demostrando que es independiente de la zona geográfica del aislamiento y que podría presentarse el mismo factor en cepas de diferente origen (Price et al., 2017). De esta forma, se podría inferir que, para los resultados encontrados con M15, se debería al efecto de la expresión y regulación de varios factores de virulencia (Leitão et al., 2010).
En el presente estudio, la aplicación de B. ubonensis y B. cepacia individual y coinoculadas promovió significativamente el crecimiento vegetal en las plantas de arroz bajo condiciones de invernadero, demostrando así el efecto benéfico de estos microorganismos, ya sea haciendo más eficiente el uso del fósforo presente en el suelo en bajas cantidades o el incorporado a través de la fertilización (Bhattacharyya et al., 2016). Resultados similares reportados por Pande et al. (2019) demostraron que cepas de B. cepacia y B. contaminans, inoculadas en maíz dulce, incrementaron la biomasa seca foliar de las plantas con valores de 0,48 y 0,32 g, respectivamente, comparadas con los tratamientos control donde el valor fue de 0,20 g. Estrada et al. (2013) evaluaron la inoculación de arroz con B. vietnamiensis y Herbaspirillum seropedicae como BSF en etapa vegetativa, evidenciando un incremento significativo en la biomasa total de las plantas con valores de 15,25 y 11,22 g, respectivamente, comparado con el testigo no inoculado, cuyo valor fue de 5,86 g. Estos resultados muestran las ventajas de Burkholderia sp. como bacteria solubilizadora de fosfato y su efecto en el aumento del rendimiento de los cultivos.
Conclusiones
De los oxisoles de la altillanura plana del departamento de Meta en Colombia se aislaron, caracterizaron e identificaron dos cepas del género Burkholderia .i. e., B. ubonensis [M15] y B. cepacia [M18]), que mostraron sobresaliente capacidad para la solubilización de fosfatos. En este estudio se demostró que la inoculación de B. ubonensis (M15) y B. cepacia (M18) en arroz incrementó significativamente el crecimiento en términos de biomasa seca foliar y radical, bajo condiciones de invernadero, en un suelo con baja disponibilidad de P. Las cepas M15 y M18 tendrían potencial para ser incorporadas como ingredientes activos en inoculantes, con capacidades para promover el crecimiento vegetal, favoreciendo la disponibilidad del P en el suelo, e incluso podrían ser compatibles con la fertilización fosfórica.
Agradecimientos
Agradecemos al Ministerio de Agricultura y Desarrollo Rural Colombiano por financiar este trabajo de investigación enmarcado en el macroproyecto “Desarrollo de estrategias tecnológicas y vinculación del conocimiento en los sistemas de producción de cultivos transitorios, en la Altillanura plana y Piedemonte llanero” (ID 129); asimismo, al departamento de Bioproductos y al laboratorio de microbiología agrícola de la Corporación Colombiana de Investigación Agropecuaria (Agrosavia), C. I. La Libertad, por el apoyo en infraestructura, equipos de laboratorios y cepas de investigación.
REFERENCIAS
Acosta-Martínez, V., Cruz, L., Sotomayor-Ramírez, D., & Pérez-Alegría, L. (2007). Enzyme activities as affected by soil properties and land use in a tropical watershed. Applied Soil Ecology, 35(1), 35-45. https://doi.org/10.1016/j.apsoil.2006.05.012 [ Links ]
Ahmed, N., & Shahab, S. (2015). Phosphate solubilization: Their mechanism genetics and application. The Internet Journal of Microbiology, 9(1), 1-19. http://doi.org/10.5580/2327 [ Links ]
Alam, S., Khalil, S., Ayub, N., & Rashid, M. (2002). In vitro solubilization of inorganic phosphate by Phosphate Solubilizing Microorganisms (PSM) from maize rhizosphere. International Journal of Agriculture and Biology, 4(4), 454-458. https://www.researchgate.net/publication/233815274 [ Links ]
Amaya-Gómez, C., Porcel, M., Mesa-Garriga, L., & Gómez, M. (2020). A framework for the selection of plant growth-promoting rhizobacteria based on 2 bacterial competence mechanisms. Applied and Environmental Microbiology, 86(14), 1-13. https://doi.org/10.1128/AEM.00760-20 [ Links ]
Aristizábal, A., Baquero, J. E., & Leal, D. (2000). Manejo eficiente de variedades mejoradas de arroz en los llanos orientales. (Boletín Técnico No. 21). http://bibliotecadigital.agronet.gov.co/bitstream/11348/6450/1/Manejo%20eficiente%20de%20variedades%20de%20arroz.pdf [ Links ]
Awais, M., Tariq, M., Ali, A., Ali, Q., Khan, A., Tabassum, B., Nasir, I. A., & Husnain, T. (2017). Isolation, characterization and inter relationship of phosphate solubilizing bacteria from the rhizosfere of sugarcane and rice. Biocatalysis and Agricultural Biotechnology, 11, 312-321. https://doi.org/10.1016/j.bcab.2017.07.018 [ Links ]
Barrera, C. M., Jakobs-Schoenwandt, D., Gómez, M. I., Becker, M., Patel, A. V., & Ruppel, S. (2019). Salt stress and hydroxyectoine enhance phosphate solubilisation and plant colonization capacity of Kosakonia radicincitans. Journal of Advanced Research, 19, 91-97. https://doi.org/10.1016/j.jare.2019.03.012 [ Links ]
Bashan, Y., Kamnev, A. A., & Bashan, L. E. (2013). A proposal for isolating and testing phosphate- solubilizing bacteria that enhance plant growth. Biology and Fertility of Soils, 49, 1-2. https://doi.org/10.1007/s00374-012-0756-4 [ Links ]
Becerra, J., Quintero, D., Martinez, M., & Matiz, A. (2011). Characterization of phosphate solubilizing microorganisms isolated from soils planted with cape gooseberry (Physalis peruviana L.). Revista Colombiana de Ciencias Hortícolas, 5(2), 195-208. http://www.scielo.org.co/scielo.php?script=sci_arttext&pid=S201121732011000200004 [ Links ]
Bhardwaj, S., Dipta, B., Kirti, S., & Kaushal, R. (2017). Screening of efficient rhizobacteria associated with cauliflower (Brassica oleracea var. botrytis L.) for plant growth promoting traits. Journal of Applied and Natural Science, 9(1), 167-172. https://doi.org/10.31018/jans.v9i1.1166 [ Links ]
Bhattacharyya, P., Goswami, M., & Bhattacharyya, L. (2016). Perspective of beneficial microbes in agriculture under changing climatic scenario: A review. Journal of Phytology, 8, 26-41. https://doi.org/10.19071/jp 2016.v8.3022 [ Links ]
Billah, M., Khan, M., Bano, A., Hassan, T. U., Munir, A., & Gurmani, A. R. (2019). Phosphorus and phosphate solubilizing bacteria: Keys for sustainable agriculture. Geomicrobiology Journal, 36(10), 904- 916. https://doi.org/10.1080/01490451.2019.1654043 [ Links ]
Borges-Baldotto, L., Altoé-Baldotto, M., Pasqualoto-Canellas, L., Bressan-Smith, R., & Lopes-Olivares, F. (2010). Growth promotion of pineapple 'Vitória' by humic acids and Burkholderia spp. during acclimatization. Revista Brasileira de Ciência do Solo, 34(5), 1593-1600. https://doi.org/10.1590/S0100-06832010000500012 [ Links ]
Bray, R. H., & Kurtz, L. T. (1945). Determination of total, organic and available forms of phosphorus in soils. Soil Science, 59(1), 39-46. http://doi.org/10.1097/00010694-194501000-00006 [ Links ]
Caballero-Mellado, J., Martínez-Aguilar, L., Paredes- Valdez, G., & Estrada-de los Santos, P. (2004). Burkholderia unamae sp. nov., an N2-fixing rhizospheric and endophytic species. International Journal of Systematic and Evolutionary Microbiology, 54, 1165-1172. https://doi.org/10.1099/ijs.0.02951-0 [ Links ]
Caballero, T., Camelo, M., Bonilla, R., & Martínez, M. (2007). Determinación de actividad fosfato solubilizadora por bacterias aisladas a partir de suelos algodoneros en los departamentos del Cesar y Meta. Suelos Ecuatoriales, 37(1), 94-100. https://sites.google.com/site/suelosecuatoriales/descarga-de-articulos/volumen-37-1 [ Links ]
Cerón, L. E., & Aristizábal, F. A. (2012). Dinámica del ciclo del nitrógeno y fosforo en suelos. Revista Colombiana de Biotecnología, 14(1), 285-295. https://repositorio.unal.edu.co/handle/unal/69611 [ Links ]
Chakraborty, B. N., Chakraborty, U., Saha, A., Sunar, H., & Dey, P. (2010). Evaluation of phosphate solubilizers from soils of north Bengal and their diversity analysis. World Journal of Agricultural Sciences, 6(2), 195-200. https://www.researchgate.net/publication/242630621_Evaluation_of_Phosphate_Solubilizers_from_Soils_of_North_Bengal_and_Their_Diversity_Analysis [ Links ]
Chung, H., Park, M., Madhaiyan, M., Seshadri, S., Song, J., Cho, H., & Sa, T. (2005). Isolation and characterization of phosphate solubilizing bacteria from the rhizosphere of crop plants of Korea. Soil Biology and Biochemistry, 37(10), 1970-1974. https://doi.org/10.1016/j.soilbio.2005.02.025 [ Links ]
Coenye, T., & Vandamme, P. (2003). Diversity and significance of Burkholderia species occupying diverse ecological niches. Environmental Microbiology, 5(9), 719-729. https://doi.org/10.1046/j.1462- 2920.2003.00471.x [ Links ]
Collavino, M., Sansberro, P., Mroginski, L., & Aguilar, M. (2010). Comparison of in vitro solubilization activity of diverse phosphate-solubilizing bacteria native to acid soil and their ability to promote Phaseolus vulgaris growth. Biology and Fertility of Soils, 46, 727-738. https://doi.org/10.1007/s00374-010-0480-x [ Links ]
Corrales-Ramírez, L. C., Arévalo-Galvez, Z. Y., & Moreno-Burbano, V. E. (2014). Solubilización de fosfatos: una función microbiana importante en el desarrollo vegetal. Nova, 12(21), 68-79. https://hemeroteca.unad.edu.co/index.php/nova/article/view/997/983 [ Links ]
Daneshgar, S., Callegari, A., Capodaglio, A. G., & Vaccari, D. (2018). The potential phosphorus crisis: Resource conservation and possible escape technologies: A Review. Resources, 7(2), 37. https://doi.org/10.3390/resources7020037 [ Links ]
Dar, A. I., Saleem, F., Ahmad, M., Tariq, M., Khan, A., Ali, A., Tabassum, B., Ali, Q., Ali, G., Rashid, B., Nasir, I. A., & Husnain, T. (2014). Characterization and efficiency assessment of PGPR for enhancement of rice (Oryza sativa L.) yield. Advancements in Life Sciences, 2(1), 38-45. http://www.als-journal.com/articles/vol2issue1/217.14/PDF.pdf [ Links ]
Dawwam, G. E., Elbeltagy, A., Emara, H. M., Abbas, I. H., & Hassan, M. M. (2013). Beneficial effect of plant growth promoting bacteria isolated from the roots of potato plant. Annals of Agricultural & Crop Sciences, 58(2), 195-201. https://doi.org/10.1016/j.aoas.2013.07.007 [ Links ]
De los Santos-Villalobos, S., Barrera-Galicia, C., Hernández-Rodríguez, L. E., & Peña- Cabriales, J. J. (2015). Potencial uso agro-biotecnológico de cepas del género Burkholderia aisladas de huertas de mango (Mangifera indica L.) v. Ataulfo en México. Revista Latinoamericana de Recursos Naturales, 11(2), 78-86. http://revista.itson.edu.mx/index.php/rlrn/article/view/241 [ Links ]
Enz, M., Dachler, C. H., & Novartis. (1998). Compendio para la identificación de los estadios fenológicos de especies mono y dicotiledóneas cultivadas, Escala BBCH extendida. https://www.agro.basf.es/Documents/es_files/pdf_1_files/services_files/descarga.pdf [ Links ]
Estrada-De los Santos, P., Bustillos-Cristales, R., Caballero-Mellado, J. (2001). Burkholderia, a genus rich in plant-associated nitrogen fixers with wide environmental and geographic distribution. Applied and Environmental Microbiology, 67(6), 2790-2798. http://doi.org/10.1128/AEM.67.6.2790–2798.2001 [ Links ]
Estrada, G. A., Divan-Baldani, V. L., Messias de Oliveira, D., Urquiaga, S., Baldani, J. I. (2013). Selection of phosphate-solubilizing diazotrophic Herbaspirillum and Burkholderia strains and their effect on rice crop yield and nutrient uptake. Plant and Soil, 369, 115-129. https://doi.org/10.1007/s11104-012-1550-7 [ Links ]
Fageria, N. K., & Baligar, V. C. (2008). Ameliorating soil acidity of tropical oxisols by liming for sustainable crop production. Advances in Agronomy, 99, 345-399. https://doi.org/10.1016/S0065-2113(08)00407-0 [ Links ]
Gao, M., Zhou, J. J., Wang, E., Chen, Q., Xu, J., & Sun, J. (2015). Multiphasic characterization of a plant growth promoting bacterial strain, Burkholderia sp. 7016 and its effect on tomato growth in the field. Journal of Integrative Agriculture, 14(9), 1855-1863. https://doi.org/10.1016/S2095-3119(14)60932-1 [ Links ]
Glickmann, E., & Deessaux, Y. (1995). A critical examination of the specificity of the Salkosky reagent for indolic compounds produced by phytopathogenic bacteria. Applied and Environmental Microbiology, 61(2), 793-796. https://aem.asm.org/content/aem/61/2/793.full.pdf [ Links ]
Gumiere, T., Rousseau, A. N., da Costa, D. P., Cassetari A., Raposo, S., Andreote F. D., Gumiere, S., & Pavinato, P. S. (2019). Phosphorus source driving the soil microbial interactions and improving sugarcane development. Scientific Reports, 9, 4400. https://doi.org/10.1038/s41598-019-40910-1 [ Links ]
Karki, H. S. (2010). Physiological, biochemical and molecular characteristics associated with virulence of Burkholderia glumae: the major causative agent of bacterial panicle blight of rice (Master's thesis, Louisiana State University, Louisiana, U.S.A. https://digitalcommons.lsu.edu/cgi/viewcontent.cgi?article=1785&context=gradschool_theses [ Links ]
King, E. O., Ward, M. K., & Raney, D. (1954). Two simple media for the demonstration of pyocyanin and fluorescin. Journal of Laboratory and Clinical Medicine, 44(2), 301-307. https://www.translationalres.com/article/0022-2143(54)90222-X/pdf [ Links ]
Krishnaraj, P. U., & Dahale S. (2014). Mineral Phosphate Solubilization: Concepts and Prospects in Sustainable Agriculture. Proceedings of the Indian National Science Academy, 80(2), 389-405. http://doi.org/10.16943/PTINSA/2014/V80I2/55116 [ Links ]
Kurita, T., & Tabei, H. (1967). On the causal agent of bacterial grain rot of rice [abstract in Japanese]. Annals of the Phytopathological Society of Japan, 33, 111. https://www.cabi.org/isc/datasheet/44964 [ Links ]
Kwak, G. Y., Choi, O., Goo, E., Rang, Y., Kim, J., & Hwang, I. (2020). Quorum sensing-independent cellulase-sensitive pellicle formation is critical for colonization of Burkholderia glumae in rice plants. Frontiers in Microbiology, 10(3090), 1-10. https://doi.org/10.3389/fmicb.2019.03090 [ Links ]
Leitão, J. H., Sousa, S. A., Ferreira, A. S., Ramos, C. G., Silva, I. N., & Moreira L. M. (2010). Pathogenicity, virulence factors, and strategies to fight against Burkholderia cepacia complex pathogens and related species. Applied Microbiology and Biotechnology, 87, 31-40. http://doi.org/10.1007/s00253-010-2528-0 [ Links ]
Li, G. X., Wu, X. Q., & Ye, J. R. (2013). Biosafety and colonization of Burkholderia multivorans WS-FJ9 and its growth-promoting effects on poplars. Applied Microbiology and Biotechnology, 97, 10489-10498. https://doi.org/10.1007/s00253-013-5276-0 [ Links ]
Liang, J. L., Liu, J., Jia, P., Yang, T.T., Zeng, Q.W., Zhang, S.C., Liao, B., Shu, W. S., & Li, J. T. (2020). Novel phosphate-solubilizing bacteria enhance soil phosphorus cycling following ecological restoration of land degraded by mining. The ISME Journal, 14, 1600-1613. https://doi.org/10.1038/s41396-020-0632-4 [ Links ]
Liu, W. H., Chen, F. F., Wang, C. E., Fu, H. H., Fang, X. Q., Ye, J. R., & Shi, J. Y. (2019). Indole-3-Acetic Acid in Burkholderia pyrrocinia JK-SH007: Enzymatic Identification of the Indole-3- Acetamide Synthesis Pathway. Frontiers in Microbiology, 10(2559). https://doi.org/10.3389/fmicb.2019.02559 [ Links ]
Lynch, J. P. (2007). Roots of the second green revolution. Australian Journal of Botany, 55(5), 493-512. https://doi.org/10.1071/BT06118 [ Links ]
Mehta, P., Walia, A., Kulshrestha, S., Chauhan, A., & Shirkot, C. K. (2015). Efficiency of plant growth promoting P-solubilizing Bacillus circulans CB7 for enhancement of tomato growth under net house conditions. Journal of Basic Microbiology, 55(1), 33-44. https://doi.org/10.1002/jobm.201300562 [ Links ]
Mora, E., & Toro, M. (2007). Estimulación del crecimiento vegetal por Burkholderia cepacia, una cepa nativa de suelos ácidos de sabanas venezolanas. Agronomía Tropical, 57(2), 123-128. http://ve.scielo.org/scielo.php?script=sci_arttext&pid=S0002192X2007000200006&lng=es&tln g=es [ Links ]
Motamedi, H., Aalivand, S., Najafzadeh-Varzi, H., & Mohammadi, M. (2016). Screening cabbage rhizosphere as a habitat for isolation of phosphate-solubilizing bacteria. Environmental and Experimental Biology, 14, 173-181. http://doi.org/10.22364/eeb.14.24 [ Links ]
Nautiyal, C. S. (1999). An efficient microbiological growth medium for screening phosphate solubilizing microorganisms. FEMS Microbiology Letters, 170(1), 265-270. https://doi.org/10.1111/j.1574-6968.1999.tb13383.x [ Links ]
Oliveira, C. A., Alves, V. M. C., Marriel, I. E., Gomes, E. A., Scotti, M. R., Carneiro, N. P., Guimarães, C. T., & Sá, N. M. H. (2009). Phosphate solubilizing microorganisms isolated from rhizosphere of maize cultivated in an oxisol of the Brazilian Cerrado Biome. Soil Biology and Biochemistry, 41(9), 1782-1787. https://doi.org/10.1016/j.soilbio.2008.01.012 [ Links ]
Ortiz, T., Ocampo, V., Prada, L. D., & Franco-Correa, M. (2016). Preservation methods for actinobacterias with phosphate solubilizing activity. Revista Colombiana de Biotecnología, 18(2), 32-39. http://dx.doi.org/10.15446/rev.colomb.biote.v18n2.47683 [ Links ]
Othman, R., & Panhwar, Q. A. (2014). Phosphate-Solubilizing Bacteria Improves Nutrient Uptake in Aerobic Rice. In M., Khan, A. Zaidi, & J. Musarrat (Eds.), Phosphate Solubilizing Microorganisms: Principles and Application of Microphos Technology (pp. 207-224). https://doi.org/10.1007/978-3-319-08216-5_9 [ Links ]
Pande, A., Kaushik, S., Pandey, P., & Negi, A. (2019). Isolation, characterization, and identification of phosphate-solubilizing Burkholderia cepacia from the sweet corn cv. Golden Bantam rhizosphere soil and effect on growth-promoting activities, International Journal of Vegetable Science, 26(6), 1-17. https://doi.org/10.1080/19315260.2019.1692121 [ Links ]
Panhwar, Q. A., Othman, R., Rahman, Z. A., Meon, S., & Ismai, M. R. (2012). Isolation and characterization of phosphate-solubilizing bacteria from aerobic rice. African Journal of Biotechnology, 11(11), 2711-2719. http://doi.org/10.5897/AJB10.2218 [ Links ]
Pérez, E., Sulbarán, M., Ball, M., & Yarzábal, L. A. (2007). Isolation and characterization of mineral phosphate-solubilizing bacteria naturally colonizing a limonitic crust in the south-eastern Venezuelan region. Soil Biology and Biochemistry, 39(11), 2905-2914. https://doi.org/10.1016/j.soilbio.2007.06.017 [ Links ]
Pikovskaya, R. I. (1948). Mobilization of phosphorus in soil connection with the vital activity of some microbial species. Microbiology, 17, 362-370. https://www.scienceopen.com/document?vid=44a8aa7f-fad0-4038-a97b-a766d1a3b6fb [ Links ]
Pineda, M. E. (2014). Phosphate solubilization as a microbial strategy for promoting plant growth. Ciencia y Tecnología Agropecuaria, 15(1), 101-113. https://doi.org/10.21930/rcta.vol15_num1_art:401 [ Links ]
Price, E. P., Sarovich, D. S., Webb, J. R., Hall, C. M., Jaramillo, S. A., Sahl, J. W., Kaestli, M., Mayo, M., Harrington, G., Baker, A. L., Sidak-Loftis, L. C., Settles, E. W., Lummis, M., Schupp, J. M., Gillece, J. D., Tuanyok, A., Warner, J., Busch, J. D., Keim, P., Currie, B. J., & Wagner, D. M. (2017). Phylogeographic, genomic, and meropenem susceptibility analysis of Burkholderia ubonensis. Plos Neglected Tropical Diseases, 11(9), 1-18. https://doi.org/10.1371/journal.pntd.0005928 [ Links ]
Puente, M., Bashan, Y., Li, C., & Lebsky, V. (2004). Microbial populations and activities in the rhizoplane of rock – weathering desert plants. Plant Biology, 6, 643-650. https://doi.org/10.1055/s-2004-821100 [ Links ]
Rashid, M., Khalil, S., Ayud, N., Alam, S., & Latif, F. (2004). Organic acids production and phosphate solubilization byphosphate solubilizing microorganisms (PSM) under in vitro conditions. Pakistan Journal of Biological Sciences, 7(2), 187-196. http://doi.org/10.3923/pjbs.2004.187.196 [ Links ]
Richardson, A., E., Lynch, J. P., Ryan, P. R., Delhaize, E., Smith, F. A., Smith, S. E., Harvey, P. R., Ryan, M. H., Veneklaas, E. J., Lambers, H., Oberson, A., Culvoner, R. A., & Simpson, R. (2011). Plant and microbial strategies to improve the phosphorus efficiency of agriculture. Plant and Soil, 349(1- 2), 121-156. https://doi.org/10.1007/s11104-011-0950-4 [ Links ]
Rivas, L., Hoyos, P., Amézquita, E., & Molina, D. L. (2004). Manejo y uso de los suelos de la Altillanura Colombiana. En Centro Internacional de Agricultura Tropical (CIAT) (Eds.), Manejo y uso de los suelos de la Altillanura Colombiana. Análisis económico de una estrategia para su conservación y mejoramiento. Construcción de la capa arable (pp. 6-12). CIAT. http://ciat-library.ciat.cgiar.org/Articulos_Ciat/degradacion_capa_arable.pdf [ Links ]
Rojas-Rojas, F. U., López-Sánchez, D., Meza-Radilla, G., Méndez-Canarios, A., Ibarra, J. A., & Estrada- de los Santos, P. (2019). El controvertido complejo Burkholderia cepacia, un grupo de especies promotoras del crecimiento vegetal y patógenas de plantas, animales y humanos. Revista Argentina de Microbiología, 51(1), 84-92. https://doi.org/10.1016/j.ram.2018.01.002 [ Links ]
Rooney, D., & Clipson, N. (2009). Phosphate addition and plant species alters microbial community structure in acidic upland grassland. Microbial Ecology, 57(1), 4-13. http://doi.org/10.1007/s00248- 008-9399-2 [ Links ]
Sashidhar, B., & Podile, A. R. (2010). Mineral phosphate solubilization by rhizosphere bacteria and scope for manipulation of the direct oxidation pathway involving glucose dehydrogenase. Journal of Applied Microbiology, 109(1), 1-12. https://doi.org/10.1111/j.1365-2672.2009.04654.x [ Links ]
Sahasrabudhe, M. M. (2011). Screening of rhizobia for indole acetic acid production. Annals of Biological Research, 2(4), 460-468. http://scholarsresearchlibrary.com/ABR-vol2-iss4/ABR-2011-2-4-460- 468.pdf [ Links ]
Sandanakirouchenane, A., Haque, E., & Geetha, T. (2017). Recent studies on N2 fixing Burkholderia isolates as a biofertilizer for the sustainable agriculture. International Journal of Current Microbiology and Applied Sciences, 6(11), 2780-2796. https://doi.org/10.20546/ijcmas.2017.611.329 [ Links ]
Satyaprakash, M., Nikitha, T., Reddi, E. U. B., Sadhana, B., & Satya-Vani, S. (2017). A review on phosphorous and phosphate solubilising bacteria and their role in plant nutrition. International Journal of Current Microbiology and Applied Sciences, 6(4), 2133-2144. https://doi.org/10.20546/ijcmas.2017.604.251 [ Links ]
Sinha, R., Khot, L. R., & Schroeder, B. K. (2017). FAIMS based sensing of Burkholderia cepacia caused sour skin in onions under bulk storage condition. Journal of Food Measurement and Characterization, 11(7), 1578-1585. https://doi.org/10.1007/s11694-017-9537-y [ Links ]
Soil Survey Staff. (1999). Soil taxonomy: A basic system of soil classification for making and interpreting soil surveys. Washington, DC, USA. (2nd ed.). Recuperado de https://www.nrcs.usda.gov/Internet/FSE_DOCUMENTS/nrcs142p2_051232.pdf [ Links ]
Soil Survey Staff. (2014). Keys to Soil Taxonomy. (12th ed.). https://www.nrcs.usda.gov/wps/portal/nrcs/detail/soils/survey/class/taxonomy/?cid=nrcs142p2_053580 [ Links ]
Soltangheisi, A., de Moraes, M. T., Cherubin, M. R., Alvarez, D. O., de Souza, L. F., Bieluczyk, W., … de Camargo, P. B. (2019). Forest conversion to pasture affects soil phosphorus dynamics and nutritional status in Brazilian Amazon. Soil and Tillage Research, 194, 104330. https://doi.org/10.1016/J.STILL.2019.104330 [ Links ]
Stephen, J., & Jisha, M. S. (2011). Gluconic acid production as the principal mechanism of mineral phosphate solubilization by Burkholderia sp. (MTCC 8369). Journal of Tropical Agriculture, 49(1-2), 99- 103. https://www.researchgate.net/publication/259299955 [ Links ]
Stone, J. K., Mayo, M., Grasso, S. A., Ginther, J. L., Warrington, S. D., Allender, C. J., … Tuanyok, A. (2012). Detection of Burkholderia pseudomallei O-antigen serotypes in near-neighbor species. BMC Microbiology, 12(250), 1-8. http://doi.org/10.1186/1471-2180-12-250 [ Links ]
Stoyanova, M., Pavlina, I., Moncheva P., & Bogatzevska, P. (2007). Biodiversity and incidence of Burkholderia Species. Biotechnology & Biotechnological Equipment, 21(3), 306-310. https://doi.org/10.1080/13102818.2007.10817465 [ Links ]
Sousa, S. A., Ramos, C. G., & Leitäo J. H. (2011). Burkholderia cepacia complex: Emerging multihost pathogens equipped with a wide range of virulence factors and determinants. International Journal of Microbiology, 2011(607575), 1-9. https://doi.org/10.1155/2011/607575 [ Links ]
Suárez-Moreno, Z. R., Caballero-Mellado, J., Coutinho, B. G., Mendonça-Previato, L., James, E. K., & Venturi, V. (2012). Common features of environmental and potentially beneficial plant associated Burkholderia. Microbial Ecology, 63(2), 249-266. https://doi.org/10.1007/s00248-011-9929-1 [ Links ]
Suliasih, S., & Widawati, S. (2005). Isolation and identification of phosphate solubilizing and nitrogen fixing bacteria from soil in Wamena Biological Garden, Jayawijaya, Papua. Biodiversitas, 6(5), 175- 177. https://doi.org/10.13057/biodiv/d060307 [ Links ]
Tabatabai, M., & Bremner, J. M. (1969). Use of p-Nitrophenyl phosphate for assay of soil phosphatase activity. Soil Biology and Biochemistry, 1(4), 301-307. https://doi.org/10.1016/0038-0717(69)90012- 1 [ Links ]
Useche, Y. M., Valencia, H., & Pérez, H. (2004) Caracterización de bacterias y hongos solubilizadores de fosfato bajo tres usos de suelo en el sur del trapecio amazónico. Acta Biológica Colombiana, 9(2), 129- 130. https://revistas.unal.edu.co/index.php/actabiol/article/view/27408/27668 [ Links ]
Venturi, V., Friscina, A., Bertani, I., Devescovi, G., & Aguilar, C. (2004). Quorum sensing in the Burkholderia cepacia complex. Research in Microbiology, 155(4), 238-244. https://doi.org/10.1016/j.resmic.2004.01.006 [ Links ]
Walkley, A., & Black, I. A. (1934). An examination of the Degtjareff method for determining soil organic matter and a proposed modification of the chromic acid titration method. Soil Science, 37(1), 29-38. http://doi.org/10.1097/00010694-193401000-00003 [ Links ]
Walpola, B. C., & Yoon, M. H. (2013). Isolation and characterization of phosphate solubilizing bacteria and their co-inoculation efficiency on tomato plant growth and phosphorous uptake. African Journal of Microbiology Research, 7(3), 266-275. http://doi.org/10.5897/AJMR12.2282 [ Links ]
Wang, M., Tachibana, S., Murai, Y., Li, L., Ling Lau, S. Y., Cao, M., Zhu, G., Hashimoto, M., & Hashidoko Y. (2016). Indole-3-acetic acid produced by Burkholderia heleia acts as a phenylacetic acid antagonist to disrupt tropolone biosynthesis in Burkholderia plantarii. Scientific Reports, 6, 22596. https://doi.org/10.1038/srep22596 [ Links ]
Weber, O. B., Muniz, C. R., Vitor, A. O., Freire, F. C. O., & Oliveira, V. M. (2007). Interaction of endophytic diazotrophic bacteria and Fusarium oxysporumf. sp. Cubense on plantlets of banana ‘Maça’. Plant and Soil, 298, 47-56. https://doi.org/10.1007/s11104-007-9335-0 [ Links ]
Wyngaard, N., Cabrera, M. L., Klaus, J. A., & Bünemann, E. K. (2016). Phosphorus in the coarse soil fraction is related to soil organic phosphorus mineralization measured by isotopic dilution. Soil Biology & Biochemistry, 96, 107-118. https://doi.org/10.1016/j.soilbio.2016.01.022 [ Links ]
Yang, W., He, Y., Xu, L., Zhang, H., & Yan, Y. (2016). A new extracellular thermo-solvent-stable lipase from Burkholderia ubonensis SL-4: Identification, characterization and application for biodiesel production. Journal of Molecular Catalysis B: Enzymatic, 126, 76-89. http://dx.doi.org/10.1016/j.molcatb.2016.02.005 [ Links ]
Zhao, K., Penttinen, P., Zhang, X., Ao, X., Liu, M., Yu, X., & Chen, Q. (2014). Maize rhizosphere in Sichuan, China, hosts plant growth promoting Burkholderia cepacia with phosphate solubilizing and antifungal abilities. Microbiological Research, 169(1), 76-82. https://doi.org/10.1016/J.MICRES.2013.07.003 [ Links ]
Zhu, J., Li, M., & Whelan, M. (2018). Phosphorus activators contribute to legacy phosphorus availability in agricultural soils: A review. Science of the Total Environment, 612, 522-537. https://doi.org/10.1016/j.scitotenv.2017.08.095 [ Links ]
Recibido: 20 de Marzo de 2020; Aprobado: 19 de Noviembre de 2020











 texto em
texto em