Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista de Medicina Veterinaria
versión impresa ISSN 0122-9354
Rev. Med. Vet. no.25 Bogotá ene./jun. 2013
Utilización de lectinas en la inhibición
de la adhesión de Pasteurella multocida
Magda Patricia Carrillo Lamus1
1 Microbióloga agrícola y veterinaria, Pontificia Universidad Javeriana, Bogotá, Colombia. Esp. MSc (C) en Salud Animal, Universidad Nacional de Colombia. Docente y coordinadora del Módulo de Medicina y Terapéutica, Facultad de Medicina Veterinaria, Fundación Universitaria San Martín, Bogotá, Colombia. Investigadora del Grupo de Patobiología Veterinaria. Gerente del Centro Especializado de Diagnóstico Veterinario (Microvet).
magda.carrillo@sanmartin
Recibido: 12 de diciembre de 2012. Aceptado: 20 de marzo de 2013
Resumen
El primer paso de la infección es la adhesión de los organismos patógenos a las células blanco. Esta característica les permite no solo penetrar y desplegar las estrategias ofensivas para iniciar la colonización, sino contribuir a la protección y el resguardo de estos a los mecanismos de defensa tanto inmunológicos como mecánicos del hospedero. Este proceso se lleva a cabo en gran medida por la interacción de lectinas, que son proteínas de origen no inmune con la capacidad de reconocer y aglutinar carbohidratos. Este mecanismo ha sido reportado para muchos microorganismos como virus y bacterias. En el caso particular de la Pasteurella multocida, que es una bacteria gramnegativa, patógena oportunista, que inicia la infección en el epitelio respiratorio de muchos animales, se han descrito sobre su superficie sustancias lectinas como la fimbria tipo IV y carbohidratos como el lipopolisacárido o la cápsula que reconocen carbohidratos y lectinas, respectivamente, sobre la superficie de las células epiteliales del tubo respiratorio, circunstancia que le permite adherirse y resguardarse del efecto mucociliar. Debido a que para la gran mayoría de estos microorganismos —incluida P. multocida— es evidente la disminución de la susceptibilidad a los antibacterianos y a la efectividad de las vacunas, se han buscado nuevas tácticas terapéuticas y profilácticas con el fin de interrumpir la infección de los patógenos por medio del bloqueo por competencia de la unión carbohidratos-lectina, donde se ve disminuida la unión del microorganismo al tejido y, por consiguiente, la infección.
Palabras clave: Pasteurella multocida, lectinas, adhesión, epitelio.
Use of Lectins in Inhibiting the Adhesion
of Pasteurella multocida
Abstract
The first step of infection is the adhesion of pathogens to target cells. This feature not only allows them to penetrate and deploy offensive strategies to initiate colonization, but to contribute to their protection and preservation against both the immunological and mechanical defense mechanisms of the host. This process is conducted largely by the interaction of lectins, which are proteins of non-immune origin with the ability to recognize and bind carbohydrates. This mechanism has been reported for many microorganisms such as bacteria and viruses. In the particular case of Pasteurella multocida, which is a Gram-negative, opportunistic pathogen bacterium that starts the infection in the respiratory epithelium of many animals, lectin substances have been described on its surface, such as type IV fimbria, and carbohydrates such as lipopolysaccharide or the capsule that recognizes carbohydrates and lectins, respectively, on the surface of epithelial cells of the trachea, a circumstance that allows it to adhere and escape the mucociliary effect. Seeing as, to most of these microorganisms —including P. multocida—the decreased susceptibility to antibacterial agents and the effectiveness of vaccines is evident, new therapeutic and prophylactic tactics have been sought in order to interrupt pathogenic infection by blocking the carbohydrate-lectin bond by competition, where the union of the microorganism to the tissue and, therefore, the infection, is diminished.
Keywords: Pasteurella multocida, lectins, adhesion, epithelium.
Utilização de lectinas na inibição da adesão
de Pasteurella multocida
Resumo
O primeiro passo da infecção é a adesão dos organismos patogênicos às células brancas. Esta característica lhes permite não só penetrar e implantar as estratégias ofensivas para iniciar a colonização, e sim contribuir à proteção e o resguardo destes aos mecanismos de defesa tanto imunológicos como mecânicos do hospedeiro. Este processo se leva a cabo em grande medida pela interação de lectinas, que são proteínas de origem não imune com a capacidade de reconhecer e aglutinar carboidratos. Este mecanismo tem sido reportado para muitos micro-organismos como vírus e bactérias. No caso particular da Pasteurella multocida, que é uma bactéria gram-negativa, patogênica oportunista, que inicia a infecção no epitélio respiratório de muitos animais, Têm sido descritas sobre sua superfície substâncias lectinas como a fimbria tipo IV e carboidratos como o lipopolissacarídeo ou a cápsula que reconhecem carboidratos e lectinas, respectivamente, sobre a superfície das células epiteliais do tubo respiratório, circunstância que lhe permite aderir-se e resguardar-se do efeito muco ciliar. Devido a que para a grande maioria destes micro-organismos —incluindo a P. multocida— é evidente a diminuição da susceptibilidade aos antibacterianos e à efetividade das vacinas, vem se procurando novas táticas terapêuticas e profiláticas com a finalidade de interromper a infecção dos patogênicos através do bloqueio por competência da união carboidratos-lectina, onde se vê diminuída a união do micro-organismo ao tecido e, por conseguinte, a infecção.
Palavras chave: Pasteurella multocida, lectinas, adesão, epitélio.
INTRODUCCIÓN
Las enfermedades infecciosas respiratorias agudas son una de las mayores causas de morbilidad y mortalidad en animales dedicados a la producción. Ello posiblemente se deba a la necesidad de criar los animales bajo sistemas intensivos; tales enfermedades son las responsables de grandes pérdidas económicas (1, 2). Dentro de la amplia gama de microorganismos potencialmente patógenos, bacterias del género Pasteurella sp. (3-5) son aisladas de animales de diversas especies, desde aves hasta mamíferos, bien sea que se encuentren sanos o enfermos (3, 6, 7). En el caso particular de los conejos, Pasteurella multocida hace parte del complejo respiratorio, esta es una de las enfermedades más comunes y severas tanto en conejos de granja como de laboratorio (8-13).
El grupo de Patobiología Veterinaria de la Universidad Nacional de Colombia (PbVUN) ha utilizado como modelo para el estudio de las enfermedades respiratorias agudas causadas por bacterias gramnegativas la producida por Pasteurella multocida en los conejos (14-16). Los trabajos iniciales se llevaron a cabo con la enfermedad natural, y se encontró que en el pulmón de los conejos afectados se producían severos cambios microvasculares particularmente en la forma septicémica de la entidad. Posteriormente, los estudios en el tracto respiratorio alto mostraron marcadas alteraciones en la fosa nasal como aumento de la actividad, hiperplasia y degeneración de las células caliciformes (CC) en el epitelio respiratorio, migración de polimorfonucleares (PMN) y escasa presencia de bacterias tanto en los animales enfermos como en los sanos (15, 17-19).
En recientes trabajos in vitro en los que se utilizaron cultivos de septo nasal de feto de conejo expuestos individualmente a P. multocida, y los cuales fueron localizados con anticuerpos policlonales inmunomarcados contra el microorganismo, se encontró que la bacteria mostraba predilección de adherirse al glicocálix de la membrana citoplasmática de las cilias de las células correspondientes en el epitelio respiratorio (18).
Este resultado es consecuente con lo descrito por diferentes grupos de investigación que reportan cómo este microorganismo utiliza adhesinas con propiedad de lectinas entre las que se encuentran el LPS y la fimbria tipo IV para reconocer y adherirse al epitelio como un primer paso en el proceso de infección, esta unión capacita a la bacteria con el fin de localizarse cerca de los suministros de alimento y resistir los embates de los fluidos que constantemente limpian las superficies de las mucosas (20), este microorganismo persiste en el sitio de unión donde prolifera, e instaura una colonización estable y produce enzimas o exotoxinas necesarias para protegerse de otras defensas del hospedero, invadir y causar síntomas clínicos (3, 21, 22); en parte debido a esto, la prevención y el tratamiento de las enfermedades causadas por P. multocida son difíciles y este proceso contribuye a la poca eficacia tanto de los antibióticos como de las vacunas (3, 23, 24).
PASTEURELLA MULTOCIDA
P. multocida hace parte de la flora normal de muchas especies animales y ha sido objeto de estudios desde 1880 cuando Louis Pasteur la reconoció como agente causal de enfermedades fatales en aves de corral; hoy en día se le involucra en enfermedades que afectan una amplia cantidad de especies animales, pero también forma parte de la flora orofaríngea normal de dichas especies (3, 22, 25-28).
Este microorganismo es un cocobacilo bipolar, no motil, gramnegativo, con 0,3-1,0 de ancho y 1,0-2,0 de largo, oxidasa y catalasa positivos, no hemolítico. Se han descrito 5 tipos capsulares (A, B, D, E y F) y 16 serotipos somáticos (29, 30). Los distintos tipos de P. multocida se asocian con enfermedades específicas en humanos (31) y diferentes especies animales; así, la rinitis atrófica de los cerdos se relaciona con los serotipos A y D; la septicemia hemorrágica en bovinos con B:2; B:2,5; E:2 y E:2,5; el cólera aviar con A, F, y eventualmente D, y el complejo respiratorio de los conejos con los serotipos A:3 y A:12 (27, 28, 32-37).
Se han descrito varios factores de virulencia para las distintas P. multocida, entre los más relevantes se cuentan el lipopolisacárido (LPS) y la cápsula que para el caso de las cepas pertenecientes al grupo A está compuesta por ácido hialurónico que es un polímero de ácido D-glucurónico y N-acety-D-glucosamina (27, 29-32). Proteínas como la proteína de membrana externa ligadora del hierro, proteasa, neuraminidasa y la porina; además, el más recientemente propuesto sistema de metilación de la adenina (22, 27, 33). En algunos serotipos como el A y D se sabe que producen una toxina denominada toxina P. multocida (PMT); esta es una proteína citotóxica de 146 kDa que actúa a través de un complejo de vías de señalización intracelular y estimula la formación de rearreglos del citoesqueleto. En conejos, la PMT purificada tiene la capacidad de iniciar neumonía aunque aún no se conoce su papel específico en la enfermedad natural (22, 27).
La cápsula le provee a P. multocida resistencia a la desecación, actividad antifagocítica, protección contra la actividad antibacteriana del complemento y actúa como receptor sobre la bacteria de lectinas ubicadas sobre las células del hospedero, mecanismo que contribuye a la adhesión previa a la infección (29, 34-36). Para la membrana externa se han descrito diferentes proteínas (OMP) que actúan como una barrera selectiva que previene el ingreso de moléculas tóxicas para la bacteria cruciales en la supervivencia de esta en medioambientes adversos y, a su vez, contribuyen en la captación de nutrientes, transporte de moléculas dentro y fuera, e interacción con los tejidos del hospedero (22, 37-39).
Los análisis de la secuencia genómica de la cepa PM70 de P. multocida han identificado un grupo de genes que codifican para una serie de proteínas involucradas en la adhesión de las bacterias al hospedero, entre aquellos se encuentran los genes que codifican para la hemaglutinina filamentosa PfbH1 y PfhB2 y las subunidades fimbriales PtfA, FimA, Fip_1 y FIp_2, y los genes que codifican para las proteínas estructurales de las fimbrias de superficie Hsf_1 y Hsf_2, a los que se les reconoce la importancia en la adhesión de este patógeno al hospedero (22, 27, 38, 40, 41).
Para el control de las infecciones producidas por P. multocida se han utilizado vacunas (bacterinas), cuya eficacia es discutible (42); en algunos casos se ha comprobado que vacunas vivas son capaces de causar enfermedad clínica (42-44), y tanto la ineficacia como el desarrollo de resistencia a los antibióticos es ampliamente conocida (45).
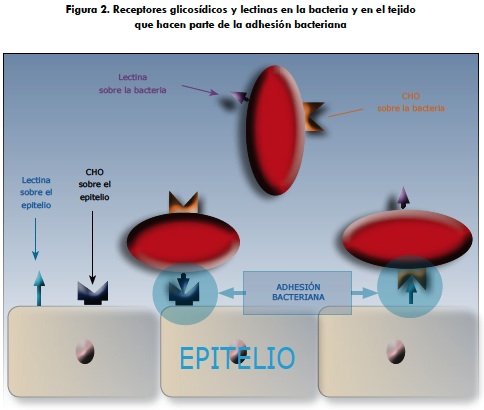
En otra vía, la patogénesis de la infección por P. multocida en el nivel molecular es poco entendida; sin embargo, es claro que además de los factores arriba comentados, sobre la bacteria existen sustancias proteicas denominadas lectinas que poseen la capacidad de reconocer carbohidratos (CHO) sobre la superficie de las células del hospedero, y a su vez sobre el epitelio existen lectinas que son reconocidas por los residuos CHO expuestos en la superficie bacteriana, que le permiten adherirse y evadir las líneas de defensa del hospedero (46-48).
LECTINAS
Las lectinas se definen como proteínas de origen no inmune que tienen especificidad por residuos de carbohidratos, monosacáridos, glicoproteínas o glicolípidos terminales o subterminales, con los que forman uniones no covalentes selectivas y reversibles, característica que les confiere la propiedad de reconocer, aglutinar células o precipitar glicoconjugados (46, 49-52). Son ubicuas en la naturaleza y se encuentran en todo tipo de organismos, desde bacterias y virus hasta plantas y vertebrados, son fáciles de detectar y a menudo de aislar, y su papel es la base de numerosos procesos biológicos (52).
El término lectina fue inicialmente propuesto por Boyd y Shapleighen en 1954 proveniente del verbo en latín Legere, el cual significa discernir, y se refiere a la marcada selectividad con la que las lectinas se unen a estructuras carbohidrato; también han sido denominadas con los nombres de hemaglutinina o fitohemaglutinina. Hoy en día la denominación más aceptada es la de lectina, la cual fue inicialmente propuesta por Goldstein et ál., en 1980, y adoptada por la nomenclatura del Comité de la Unión Internacional de Bioquímica.
Las lectinas son diversas estructuralmente, con grandes diferencias en tamaño, estructura terciaria y cuaternaria, y la estructura de los sitios de combinación llamados DRC (dominio de reconocimiento de carbohidratos), tienen la capacidad de unirse a ciertos azúcares mediante interacciones moleculares no covalentes como fuerzas de van der Waals, puentes de hidrógeno, interacciones iónicas e interacciones electrostáticas. La unión entre la lectina y el carbohidrato ocurre por lo menos en dos puntos de cada molécula y es fundamental la disposición espacial del DRC, que forma una "bolsa" en la que ingresa el carbohidrato. A pesar de que cada lectina tiene predilección por un CHO específico puede tener un DRC secundario, es decir, reconocer en menor grado otros azúcares y, en algunos casos, en la afinidad pueden contribuir los polisacáridos vecinos a estos últimos (53). Es común que lectinas con características muy diferentes reconozcan el mismo carbohidrato y que algunas lectinas semejantes tengan afinidad por distintos azúcares. Las lectinas siempre tienen afinidad principal por un carbohidrato específico, pero pueden tenerla por otros residuos (53-55).
Desde principios del siglo XIX se conoce a las lectinas como proteínas con actividad hemaglutinante y perteneciente de manera exclusiva al reino de las plantas, y no se les prestó mayor atención hasta la década de los sesenta cuando se les empezó a utilizar como herramientas importantes en el estudio de los carbohidratos (simples y complejos) en solución o en superficies celulares y caracterización celular (56-58). Las funciones de las lectinas son diversas pero en su mayoría son de reconocimiento, de adhesión de células o sustancias que incluyen síntesis enzimática, degradación de oligo y polisacáridos, transporte de carbohidratos, respuesta inmunológica a antígenos carbohidratos y migración de leucocitos a sitios de inflamación. El hallazgo de que las de las lectinas WGA (wheat germ), Canavalia ensiformis (concanavalin A) y SBA (soybean) aglutinan células malignas y no lo hacen con células normales provee información que indica que el cáncer podría estar asociado con cambios en los azúcares de las superficies celulares y permite la aplicación de las lectinas en la investigación de esta enfermedad (56-58). En el caso de las interacciones bacterianas las más importantes son las que son irreversibles y esto le permite ser más resistente a la acción mecánica de defensa del organismo, son interacciones altamente específicas donde la bacteria se une solamente a un sustrato que posee un tipo de receptor CHO específico, un ejemplo clásico es la adhesión entre una lectina bacteriana como la fimbria tipo IV presente en Pasteurella multocida y el carbohidrato específico manosa sobre la superficie del hospedero, en este caso solo las bacterias que poseen una lectina que reconozca este carbohidrato en particular podrán adherirse al epitelio del hospedero (52, 59, 60).
Las fimbrias son multisubunidades submicroscópicas también llamadas pilis, que diferencian carbohidratos específicos. Esta característica ha sido repetidamente reportada en Escherichia coli K99 que posee especificidad por el ácido N-glicolilneuramínico, lo cual es fundamental debido a que en la infección por este microorganismo en cerdos esta sustancia se encuentra en las células intestinales de los animales recién nacidos y es remplazada por ácido N-acetilneuramínico en el proceso de crecimiento y desarrollo del animal, es por esto que este patógeno lo reconoce y causa diarrea a menudo fatal en lechones pero no en animales adultos (61).
En la práctica clínica y de laboratorio las lectinas son utilizadas de diversas formas como la identificación de tipos celulares particulares como es el caso de células neoplásicas, diferenciación de tipos sanguíneos o en el estudio de la función específica de linfocitos de acuerdo con la expresión de carbohidratos en su superficie; también se las emplea en la identificación de microorganismos y en la terapia antiadhesión contra ellos (62-64).
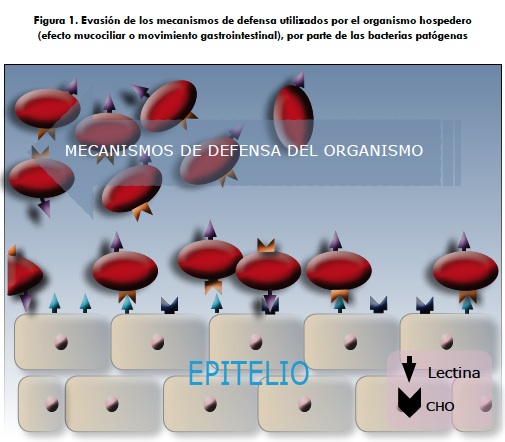
La mayoría de las enfermedades infecciosas inician con la adhesión de un organismo patógeno a las células de la mucosa del hospedero. La adhesión es requerida para evitar el lavado y desalojo de los patógenos por los mecanismos fisiológicos característicos del tejido involucrado, como por ejemplo, el movimiento permanente del tracto gastrointestinal o la acción mucociliar del tracto respiratorio (figura 1). Este contacto también le permite a los patógenos un mejor acceso a los recursos nutricios, facilita la liberación de toxinas en el hospedero y la eventual penetración del patógeno a los tejidos. En muchos casos, la unión es mediada por lectinas presentes en la superficie de los microorganismos que se unen a glicoproteínas o glicolípidos en la superficie de los tejidos del hospedero como es el caso de los apéndices filamentosos largos y cortos reconocidos como pilis o fimbrias que protruyen desde la superficie de los microorganismos (figura 2) (65-68); la especificidad de las lectinas es seguramente uno de los factores determinantes que no solo reconoce qué especie colonizar sino que además determina cuándo debe iniciarse esta colonización, y reside en lectinas de ambas superficies —la del hospedero y la de los patógenos— que reconocen glicoproteínas y glicolípidos particulares en la membrana de su contraparte (52, 68).
El caso de Pasteurella multocida no es diferente. Glorioso et ál. (69) estudiaron la adhesión de P. multocida en monocapas de cultivos de células HeLa y células paraqueratóticas faríngeas donde el hallazgo más representativo fue la inhibición de la adhesión de la bacteria a los dos tipos celulares con N-acetil-D-glucosamina, lo que sugiere que existen receptores tipo lectinas sobre ambas superficies epiteliales que actúan como mediadores de la unión bacteriana a las células del hospedero; este papel se le atribuye en buena medida a las fimbrias que cuando están presentes en determinadas cepas se observa un elevado patrón de adhesión y la ausencia de estas en la misma cepa muestra poca o ninguna adhesividad (66). Este hallazgo es consecuente con lo descrito por Al-Haddawi et ál. (70) que explican cómo la fimbria reconoce a la N-acetil-D-glucosamina presente en las cilias del epitelio respiratorio y, a su vez, reitera que con la utilización de N-acetil-D-glucosamina es posible bloquear por competencia tal unión (fimbria-CHO). Por otra parte, el ácido hialurónico presente en el serotipo capsular A es posible que contribuya a la unión, en este caso actuando como receptor de lectinas ubicadas sobre el epitelio, aunque para la P. multocida contribuiría más a la evasión de los mecanismos del sistema inmune (62, 71-73). Jacques et ál. (74) y Hatfaludi et ál. (22) sostienen que a pesar de que P. multocida posee diferentes estructuras que contribuyen a la unión a las células del epitelio respiratorio, el LPS y la fimbria tipo IV serían los principales mediadores de dicha adhesión actuando como receptor CHO y lectina respectivamente (75). Estudios con P. multocida A:3 aislada de conejos enfermos encontraron que la disminución del material capsular y la presencia de la fimbria incrementaron la adhesión de la bacteria a la tráquea (46, 49, 66, 70).
Las lectinas fimbriales de superficie son estructuras submicroscópicas elongadas relativamente rígidas, filamentos (0,2-20 nm de largo) constituidos por cientos de subunidades proteicas heterooligoméricas; estas estructuras multiplican las posibilidades de interacción con los receptores de superficie de los hospederos y permiten una fuerte adhesión; por ejemplo, E. coli con las fimbrias tipo 1 (lectina específica para manosa) o tipo P (lectina específica para galactosa) se adhieren a las células epiteliales en el tracto gastrointestinal y el tracto urinario, y eluden la remoción como consecuencia de los fluidos como la orina (22, 76-78).
TERAPIA ANTIADHESIVA
Las vacunas contraadhesinas bacterianas tipo lectina han mostrado eficacia en bovinos y cerdos, por ejemplo, el inmunizar vacas con adhesinas fimbriales permite la producción de anticuerpos antifimbriales en la leche que hacen posible que los terneros adquieran resistencia a los problemas diarreicos. Por otra parte, existe un incremento en la resistencia bacteriana a las drogas antimicrobianas y a la vacunación que obliga a la comunidad científica a investigar sobre nuevas alternativas terapéuticas (78). Una alternativa a las anteriores aproximaciones para la prevención y el control de las infección de origen bacteriano que ha mostrado resultados prometedores es el uso de sustancias que interfieren con la habilidad de las bacterias de adherirse a los tejidos del hospedero que es un requisito para la infección, más específicamente, se ha implementado el uso de azúcares con capacidad de interferir en la adhesión de estos microorganismos a través de sus ligandos con propiedades de lectinas a los CHO de las membranas de las distintas superficies de sus hospederos (61, 64, 76, 78, 79).
El proceso de adhesión no es tan simple como habitualmente se describe, puesto que un mismo tipo bacteriano puede coexpresar más de un tipo de estructuras de adhesión y más de una lectina, aún más, la expresión misma de las lectinas es dependiente de las condiciones de crecimiento en el microambiente en el que se encuentre la bacteria (64, 76, 78, 79). Con todo, uno de los principales mecanismos de adhesión de que disponen las bacterias son sus constituyentes glicosídicos, bien sea en forma de glicoproteínas como las lectinas o como azúcares complejos; así, para P. multocida entre el 20 y el 30 % de todos sus genes codifican para proteínas de membrana (OMP) y cerca del 50 % del total de la masa de la membrana externa está compuesta por proteínas (22); por tanto, una inhibición de uno de los constituyentes más abundantes de la superficie adhesiva de este grupo de patógenos seguramente se reflejará en cantidades menores de los adheridos y, en consecuencia, menores oportunidades de iniciar infección, colonización y enfermedad. La terapia antiadhesiva con base en productos inocuos, en buena parte propios de los mismos microorganismos como los CHO, es una alternativa con diferentes ventajas frente a terapias un tanto más agresivas; para ello se utilizan productos naturales biodegradables; inocuos para el hospedero, para los propios microorganismos y el ambiente; muy económicos; de fácil consecución, y no generan resistencia (65, 76, 78, 80, 81).
Un ejemplo de actividad antiadhesiva natural son las secreciones mucosas presentes en todas las superficies epiteliales y en fluidos corporales de las distintas especies animales. El moco está compuesto por una mezcla de agua, iones, lípidos, proteínas y glicoproteínas denominadas mucinas, estas últimas son la mayor macromolécula constitutiva del moco epitelial y están fuertemente implicadas en la salud y enfermedad de estos tejidos; en la mayoría de los epitelios animales las mucinas son un grupo heterogéneo de glicoproteínas de superficie altamente glicosiladas, es decir, sustituidas con oligosacáridos; entre el 50 % y 90 % del peso molecular de las mucinas está compuesto por carbohidratos como N-acetil-D-galactosamina, N-acetil-D-glucosa y pequeñas cantidades de manosa, fucosa, arabinosa, glucosa, xilosa y galactosa, y a pesar de que debido a su composición se ha demostrado el papel de la mucina en la adhesión celular, en la mayoría de los casos las mucinas tienen una fuerte actividad antiadherente (82-84). Existen excelentes ejemplos evolutivos que ilustran con claridad la extensión y los beneficios derivados de esta forma de defensa; así, algunos organismos acuáticos secretan mucinas, carbohidratos antiadhesivos y lectinas que reducen el potencial adhesivo de microorganismos patógenos como la Pseudomona fluorescens (83), también lo ilustra muy bien el componente sulfatado en el moco de la mucosa gástrica que inhibe la adhesión del Helicobacter pylori, a menos que los componentes del moco se alteren durante la inflamación (65, 76, 78).
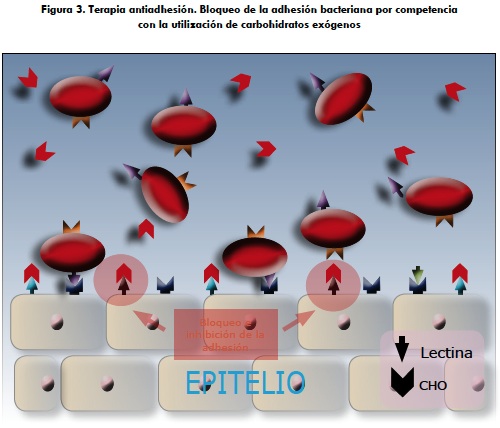
Un ejemplo clásico de eficacia de la terapia antiadherente a través de CHO (cuyos constituyentes principales son taninos condensados o proantocianidinas) de origen natural lo compone el uso del jugo de arándano (Vaccinium sp.) utilizado en el tratamiento de infecciones urinarias recurrentes por E. coli en el humano, que también disminuye la adhesión de Streptococcus mutans principal causante de las caries dentales (figura 3) (76, 68, 75, 85, 86).
La terapia antiadhesión también tiene algunas limitaciones, y esto se debe a que existen muchos genes en los microorganismos que codifican para diferentes adhesinas dato que indica que se necesita una mezcla de agentes antiadhesión para tener resultados efectivos. También es importante recordar que la bacteria es un organismo dinámico que expresa diferentes adhesinas en las distintas etapas de su proceso infeccioso, lo que puede conducir a que la bacteria se adapte al nuevo medioambiente por mutaciones o transferencia de material genético; por consiguiente, como ocurre con los antibióticos, puede darse un cambio en la bacteria que le permita desarrollar resistencia a los agentes antiadhesión. Sin embargo, si esto sucede seguramente será un mecanismo que se desarrolle de una manera mucho más lenta que con los antibacterianos debido a que los agentes que son utilizados no son bactericidas, y la propagación y distribución de las cepas resistentes es mucho menor a la que ocurre ante sustancias antibióticas (75, 76, 78).
CONCLUSIONES
En medicina humana es ya un lugar común señalar los inconvenientes que representa el tratamiento de las distintas infecciones bacterianas con sustancias antimicrobianas (24). También en el ámbito de la medicina veterinaria tales inconvenientes adquieren un rol significativo por el menor control en el uso de estas sustancias, particularmente en las especies animales destinadas al consumo humano (87); en consecuencia, cantidades residuales de ellas llegan permanentemente a la cadena alimenticia del humano vía la ingestión de carnes o leche de animales que han sido sometidos a permanentes tratamientos con los antibacterianos, la mayoría de las veces de forma inadecuada.
Por otro lado, para la prevención de la infección y enfermedad por P. multocida en las especies susceptibles de ser infectadas por este microorganismo se han ensayado múltiples aproximaciones para la utilización de vacunas, sin resultados satisfactorios (27, 29, 43, 42, 61, 78). Esto ha llevado a la búsqueda de alternativas para la prevención y eventual tratamiento de diferentes agentes bacterianos, y en el caso particular de la P. multocida por medio de una estrategia no destructiva del patógeno sino impidiéndole su primer paso de patogenicidad como es la adhesión a receptores glicosídicos en la membrana apical de la células del epitelio respiratorio, sitio inicial de colonización antes de su diseminación a regiones más profundas del sistema respiratorio, como consecuencia de condiciones ambientales no completamente conocidas, con resultados más catastróficos para el hospedero (88-90). Por tanto, llevar a cabo tal estrategia no destructiva por medio de una terapia preventiva de la infección y colonización antes de que el patógeno ejerza efectos dañinos sobre las células del tracto respiratorio superior permitiría impedir que alcance lugares más profundos como el pulmón (27, 29, 61).
En consonancia con lo anterior, y además de la putativa ventaja de ejercer una menor presión evolutiva a formas más virulentas de algunas bacterias (61, 80), el empleo de CHO como posibles preventivos de su adhesión tendría beneficios adicionales entre los que se encuentran: los azúcares son de fácil obtención y aplicación, son muy solubles en agua y poseen un pH estable (83). Se cita el ejemplo del jugo de arándano que, al ser ingerido, inhibe la adhesión de E. coli al epitelio urogenital (80). Adicionalmente, los CHO, por ser sustancias naturales, podrían ser menos nocivos para el organismo hospedero debido al bajo efecto citotóxico de los mismos en comparación con algunas lectinas (52).
Debido a que las lectinas reconocen y se unen a CHO como el ácido N-acetilneuramínico (ácido siálico), N-acetil-D-galactosamina, D-galactosa, D-manosa localizados en la membrana apical de las células del epitelio respiratorio, incluidas las cilias, estos últimos actuarían como receptores para dichas lectinas, propias de la superficie de P. multocida a las cuales se unen, como evidencia de que P. multocida tiene estructuras con comportamiento similar a estas lectinas como es el caso de la fimbria, la cual además de sus propiedades adhesivas tiene otras protectoras para el patógeno como son la disminución de la acción del moco respiratorio y de la fagocitosis (53, 58, 80, 91, 92).
Glorioso et ál. (69), Sharon et ál. (64), Ofek y Doyle (65) y Ruffolo et ál. (66) reportaron que sobre la superficie bacteriana existen residuos de D-manosa, D-glucosa, D-galactosa, N-acetil-D-glucosamina, N-acetil-D-galactosamina probablemente localizados en la cápsula o en la cadena O del LPS, y que la bacteria aprovecha entre otros procesos para interactuar con el moco y reconocer sustancias con propiedad de lectinas ubicadas sobre el epitelio; debido a esta característica dichas lectinas pueden reconocer, aglutinar y precipitar al microorganismo (52, 62, 71, 93); un ejemplo de ello son las colectinas que se ha reportado que interactúan con el antígeno O del LPS de Bordetella bronchiseptica (11). Y de acuerdo con esto, según una propuesta aún más interesante, consecuente con los estudios realizados por Sharon y Lis (52), se pueden utilizar como estrategia terapéutica o profiláctica estos mismos CHO. Como en los estudios reportados por Al-Haddawi et ál. (70), la inhibición de la adhesión de Pasteurella multocida a cultivos de células HeLa se dio por la previa aplicación de N-acetil-D-glucosamina a las células.
Esto demuestra que es posible bloquear la unión de la P. multocida al epitelio respiratorio del septo nasal de conejos y, a través de tal bloqueo, impedir que el patógeno induzca lesiones sobre dichas células; como consecuencia de ello, es probable que las mismas células epiteliales, al no sufrir daño por el patógeno, estén en capacidad de ejercer sus funciones protectoras innatas, de manera sobresaliente el barrido mucociliar.
REFERENCIAS
1. Griffin D. Economic impact associated with respiratory disease in beef cattle. Vet Clin of North Am Food Anim Pract. 1997; 13: 367-377. [ Links ]
2. Bureau F, Detilieux J, Dorts T, Uysíepruyst Ch, Coghe J, Leroy Pl et ál. Spirometric performance in belgian blue calves: Effects on economic losses due to the bovine respiratory compiex. J Anim Sci. 79: 2001: 1301-1304. [ Links ]
3. Harper M, Boyce J, Adler B. Minireview: Pasteurella multocida pathogenesis: 125 years after Pasteur. FEMS Microbiol Lett. 2006; (265): 1-10 [ Links ]
4. Moreno A. Aislamiento y tipificación de Pasteurella multocida y Bordetella bronchiseptica involucradas en el complejo neumónico de conejos en una granja de la sabana de Bogotá. Tesis. Facultad de Medicina Veterinaria y de Zootecnia. Universidad Nacional de Colombia; 1995. [ Links ]
5. Hodgson C, Lainson A, ZadoksHotchkiss R. Multilocus sequence typing of a global collection of Pasteurella multocida isolates from cattle and other host species demonstrates niche association. BMC Microbiology. 2011; 11: 115. [ Links ]
6. Al-haj Alia H, Sawadaa T, Hatakeyamab H, Katayamac Y, Ohtsukid N, Itohd O. Invasion of chicken embryo fibroblast cells by avian Pasteurella multocida. Vet Microb. 2004; (104): 55-62 [ Links ]
7. Orth J, Aktories K. Review: Pasteurella multocida Toxin Activates Various Heterotrimeric G. Proteins by Deamidation. Toxins. 2010; 2: 205-214. [ Links ]
8. Flatt R, Dungworth D. Enzootic pneumonía in rabbits microbiology and comparison with lesions experimentally produced by Pasteurella multocida and clamydial organism. Am J Vet Res. 1971; 32: 627-637. [ Links ]
9. Deeb B, Digiacomo R, Bernard Bl, Silvernagel S. Pasteurella multocida and infections in rabbits. J Clin Microbiol. 1990; 28: 70-75. [ Links ]
10. Bonilla F, García-Delgado G. Adherence of Pasteurella multocida to rabbit respiratory epithelial cells in vitro. Rev LatAmer Microbiol. 1993; 35: 361-369. [ Links ]
11. Huertas C, Iregui C. Estudio prospectivo de la neumonía enzoótica por Pasteurella multocida y Bordetella bronchiseptica en dos granjas cunículas en la altillanura de Bogotá. Abstracts XV Congreso Panamericano de Ciencias Veterinarias. Campo Grande, MS-Brasil; 1996. p. 109: 257. [ Links ]
12. Deeb B, Digiacomo R. Respiratory diseases of rabbits. Res Med. 2000; 3: 465-480. [ Links ]
13. Suelam I, Samie A, Molecular Diversity of Pasteurella multocida Isolated From Different Rabbit Outbreaks at Zagazig Suburbs, Egypt. Global Vet. 2011; 6 (2): 208-212. [ Links ]
14. Murillo J, Iregui C. Descripción morfológica de la presencia de bacterias durante el curso del síndrome de neumonía enzoótica en conejos. Rev Acovez. 1993; 17: 23-26. [ Links ]
15. Botero L, Iregui C. Caracterización por inmunohistoquímica de la relación de la Pasteurella multocida y la Bordetella bronchiseptica con el epitelio de fosas nasales y nasofaringe durante el curso de la neumonía enzoótica de los conejos. Rev Med Vet Zoot. 1999; 46: 3-12. [ Links ]
16. Iregui C, Botero L, Figueroa J. Modelo de los mecanismos moleculares del inicio de la infección por bacterias gramnegativas en tracto respiratorio alto. Proyecto presentado a la División de Investigación sede Bogotá (DIB). Universidad Nacional de Colombia; 2001. [ Links ]
17. Esquinas P, Iregui C, Botero L. Comparación ultraestructural de fosa nasal y nasofaringe de conejos sanos y enfermos con el síndrome de neumonía enzoótica. Memorias Cuarta Reunión Argentina de Patobiología Veterinaria. La Plata, Argentina; 2004: 56. [ Links ]
18. Esquinas P. Interacción in vitro entre la Pasteurella multocida y/o su lipopolisacárido con epitelio de septo nasal de conejo. Tesis de Maestría. Universidad Nacional de Colombia; 2006. [ Links ]
19. Doncel B. Cuantificación y caracterización histoquímica preliminar de las células caliciformes en fosa nasal y nasofaringe de conejos sanos y con el síndrome de neumonía enzoótica. Tesis de Maestría, Universidad Nacional de Colombia; 2004. [ Links ]
20. Hartmann M, Lindhorst T. The Bacterial Lectin FimH, a Target for Drug Discovery - Carbohydrate Inhibitors of Type 1 Fimbriae-Mediated Bacterial Adhesion. Eur J Org Chem. 2011: 3583-3609. [ Links ]
21. Firon F, Ofek I, Sharon N. Carbohydrate-binding sites of the mannose-specific fimbrial lectins of enterobacteria. Infect Immun. 1984; 43 (3): 1088-1090. [ Links ]
22. Hatfaludi T, Al-Hasani K, Boyce J, Adler B. Review: Outer membrane proteins of Pasteurella multocida. Vet Microb. 2010; 144: 1-17. [ Links ]
23. Dowling A, Hodgson JC, Dagleish MP, Eskersall PD, Sales J. Pathophysiological and immune cell response in calves prior to and following lung challenge with formalin-killed Pasteurella multocida biotype A:3 and protection studies involving subsequent homologous live challenge. Vet Immun Immunopat. 2004; 100: 197-207. [ Links ]
24. Kumarasamy K, Toleman M, Walsh T, Bagaria J, Butt F, Balakrishnan R et ál. Emergence of a new antibiotic resistance mechanism in India, Pakistan, and the UK: a molecular, biological, and epidemiological study. Reflection and reaction. 2010; 10: 70143-2. [ Links ]
25. Davies R, MacCorquodaie R, Reilly S. Characterisation of bovine strains of Pasteurella multocida and comparision with isolates of avian, ovine and porcine origin. Vet Med. 1994; 99: 145-158. [ Links ]
26. Cohen J. The immunopathogenesis of sepsis. Nature. 2002; 420: 885-891. [ Links ]
27. Boyce J, Lo C, Wilkie I, Adler B. Pathogenesis of bacterial infections in animals. 3 edition. Chapter 20. Blackwell Publishing; 2004. [ Links ]
28. Harper M, St. Michael F, John M, Vinogradov E, Adler B, Boyce J, Cox A. Pasteurella multocida Heddleston serovars 1 and 14 express different lipopolysaccharide structures but share the same lipopolysaccharide biosynthesis outer core locus. Vet Microb. 2011; 150: 289-296. [ Links ]
29. Boyce J, Adler B. The capsule is a virulence determinant in the pathogenesis of Pasteurella multocida M1404 (B:2) Infec Immun. 2000; 68: 3463-3468. [ Links ]
30. Townsend K, Boyce J, Chung J, Frost A, Adler B. Genetic organization of Pasteurella multocida cap loci and development of a multiplex capsular PCR typing system. J Clin Microbiol. 2001; 39 (3): 924-929. [ Links ]
31. Caroff M, Karibian D, Cavaillon J, Haeffner-Cavaillon N. Forum in immunology: structural and functional analyses of bacterial lipopoly saccharides. Microbes and Infection. 2002; 4: 915-926. [ Links ]
32. St. Michael F, Vinogradov E, Li J, Cox J. Structural analysis of the lipopolysaccharide from Pasteurella multocida genome strain pm70 and identification of the putative lipopoly saccharide glycosyl transferases. Glycobiology. 2004; 15:4. [ Links ]
33. Chen L, Paulsen D, Scruggs D, Banes M, Reeks B, Lawrence, M. Alteration of DNA adenine methylase (dam) activity Pasteurella multocida causes increased spontaneous frequency and attenuation in mice. Microbiology. 2003; 149: 2283-2290. [ Links ]
34. Pruimboom I, Rimler R, Ackermann M. Enhanced adhesion of Pasteurella multocida to cultured turkey peripheral blood monocytes. Infect Immun. 1999; 67: 1292-1296. [ Links ]
35. Steen J, Steen J, Harrison P, Seemann T, Wilkie I, Harper M et ál. PFis Is Essential for Capsule Production in Pasteurella multocida and regulates Expression of other Important Virulence Factors. Plos Pathogens. 2010; 6 (2): 1-14. [ Links ]
36. Sthitmatee N, Kataoka Y, Sawada T. Inhibition of capsular protein synthesis of Pasteurella multocida strain P-1059. J Vet Med Sci. 2011; 73 (11): 1445-1451. [ Links ]
37. Confer A, Suckow M, Montelargo M, Dabo S, Milocio L, Gillestie A, Merediyh G. Intranasal vaccination of rabbits with Pasteurella multocida outer membranes that express iron-regulated proteins. Am J Vet Res. 2001; 62 (5): 697-703. [ Links ]
38. Bosch M, Garrido E, Llagostera M, Pérez De Rozas A, Badiola L, Barbé I. Caracterization of the Pasteurella multocida hgba gene encoding a Hemoglobin-binding protein. Infect Immun. 2002; 70 (11): 5955-5964. [ Links ]
39. Balkovetz DF, Katz J. Review: Bacterial invasion by a paracellular route: divide and conquer. Microb Infect. 2003; 5: 613-619. [ Links ]
40. Bosch M, Garrido E, Llagostera M, Pérez de Rozas A, Badiola L, Barbé I. Caracterization of the Pasteurella multocida hgba gene encoding a hemoglobin-binding protein. Infect Immun. 2002; 70 (11): 5955-5964. [ Links ]
41. Hartmann M, Lindhorst T. The Bacterial Lectin FimH, a Target for Drug Discovery - Carbohydrate Inhibitors of Type 1 Fimbriae-Mediated Bacterial Adhesion. Eur J Org Chem. 2011: 3583-3609. [ Links ]
42. Suckow M, Haab R, Miloscio L, Guilloud N. Field trial of a Pasteurella multocida extract. Vaccine in rabbits. J Amer Assoc Lab Anim Scien Jan. 2008; 47 (1): 18-21. [ Links ]
43. Rimler R, Rebers P, Rhoades, K. Fowl Cholera: cross-protection induced by Pasteurella multocida separated from infected turkey blood. Avian Dis. 1979; 23: 730-741. [ Links ]
44. Verma R, Jaiswal T. Haemorrhagic Septicaemia Vaccines. Vaccine. 1998; 16: 1184-1192. [ Links ]
45. Dowling A, Hodgson J, Dagleish M, Eskersall P, Sales J. Pathophysiological and immune cell response in calves prior to and following lung challenge with formalin-killed Pasteurella multocida biotype a:3 and protection studies involving subsequent homologous live challenge. Vet Immun Immunopat. 2004; 100: 197-207. [ Links ]
46. Perfumo C, Itagaki S, Venturini C, Doi K. Aplicación de técnicas de lectina histoquímica para la identificación de géneros de bacterias patógenas primarias del pulmón del cerdo y del conejo; 1985. [ Links ]
47. Paustian M, May B, Kapur V. Pasteurella multocida gene expression in response iron limitation. Infect Immun. 2001; 69: 4109-4115. [ Links ]
48. Boyce J, Wilkie L, Harper M, Paustian M, Kapur V, Adler B. Genomic-scale analysis of Pasteurella multocida gene expression during growth within the natural chicken host. Infect Immun. 2002; 70: 6871-6879. [ Links ]
49. Perfumo C, Mores N, Armocida A, Piffer L, Massone A, Itagaki S. Histochemical and lectinhistochemical studies on nasal mucosa on pigs with or without respiratory diseases. J Vet Med Sci. 1998; 60: 1021-1023. [ Links ]
50. Barbeito C, Massone A, Quiroga M. Aplicación de las técnicas de lectin-histoquímica. Aplicaciones en patología veterinaria. La Plata: Universidad Nacional de La Plata; 1990. [ Links ]
51. Peacock J, Colsky A, Pinio V. Lectins and antibodies as tool for studying cellular interactions. J Immunol Meth. 1990; 126: 147-157. [ Links ]
52. Sharon N, Lis H. Lectins. 2 Edition. Dordrecht: Kluwer Academic Publishers; 2003. [ Links ]
53. Sharon N. Atomic Basis of Protein-Carbohydrate Interactions: An Overview. Chapter 1; 2005. p. 1-5. [ Links ]
54. Barondes, H. Lectins: their multiple endogenous cellular functions. Ann Rev Biochero. 1981; 207-231. [ Links ]
55. Roth J. Cellular Sialoglycoconjugates: A Histochemical Perspective. Histochem J. 1993; 25: 687-710. [ Links ]
56. Spicer S, Baron D, Sato A, Schulte, B. Variability of cell surface glycoconjugates - relation to differences in cell function. J Histochem Citochem 1981; 29 (9): 994-1002. [ Links ]
57. Corredor C. Glicoproteinas Salivares: variaciones interpersonales detectadas por lectinas. Odontológica Maxilofacial. SCCOMF. 1988; 3: 9-18. [ Links ]
58. Sharon N. Lectins: past, present and future. Biochem Soc Trans 2008; 36: 1457-1460. [ Links ]
59. Doyle R, Keller K. Lectins and diagnostic microbiology. Eur J Clin Microbiol. 1984; 3: 4-9. [ Links ]
60. Corredor C. Electroforesis de afinidad para el estudio de glicoproteinas séricas o salivares. Odontológica maxilofacial. SCCOMF. 1990; 4: 28-38. [ Links ]
61. Ofek I, Sharon N. Visions & Reflections. A bright future for anti-adhesion therapy of infectious diseases. Cell Molec Life Scien. 2002; 59: 1666-1667. [ Links ]
62. Pistole T. Interaction of bacteria and fungi with lectins and Lectin-like substances. Ann Rev Microbiol. 1981; 35: 85-111. [ Links ]
63. Danguy A, Kiss R, Pasteels J. Lectins in histochemistry. A survey. Biological Structures and Morphogeneseis. 1988; 1 (3): 93-106. [ Links ]
64. Sharon N. Lectins: carbohydrate-specific reagents and biological recognition molecules. J Biol Chem. 2007; 282 (5): 2753-2764. [ Links ]
65. Ofek I, Doyle R. Bacterial Adhesion to Cells and Tissues. T Mic. 1994; 3 (4): 163. [ Links ]
66. Ruffolo C, Tennent J, Michalski W, Adler B. Identification, Purification, and Characterization of the Type 4 Fimbriae of Pasteurella multocida. Infect Immun. 1997; 65 (1): 339-343. [ Links ]
67. Chiu C, Wong S, Hancock R, Speert D, Adherence of Burkholderia cepacia torespiratory tract epithelial cells and inhibition with dextrans. Microbiology. 2001; 147: 2651-2658. [ Links ]
68. Acord J, Maskell J, Sefton A. A rapid microplate method for quantifying inhibition of bacterial adhesion to eukaryotic cells. J Microb Met. 2005; 60: 55-62. [ Links ]
69. Glorioso J, Jones G, Rush H, Pentler L, Darif C, Coward J. Adhesion type A Pasteurella multocida to rabbit pharyngeal cells and its possibie role in rabbit respiratory tract infections. Infec Immun. 1982; 35: 1103-1109. [ Links ]
70. Al-Haddawi M, Jasni S, Zamri-Saad M, Mutalib A, Zulkifüz L, Son R. In vitro study of Pasteurella multocida adhesion to trachea, lung and aorta of rabbits. Vet J. 2000; 159: 274-281. [ Links ]
71. Payne P, Campbell S, Patchetl R. Kroll R. The use of immobilized lectins in the separation of Staphylococcus aureus, Escherichia coli, Listeria and Salmonella spp. from pure cultures and foods. J Appli Bact. 1992; 73: 41-52. [ Links ]
72. Jacques M, Foiry B. Electron microscopic visualization of capsular material of Pasteurella multocida types and labeled with polycationic ferritin. Infect Immune. 1987; 169: 8. [ Links ]
73. Qaddoumi M, Lee V. Lectins as Endocytic Ligands: An Assessment of Lectin Binding and Uptake to Rabbit Conjunctival Epithelial Cells. Pharm Res. 2004; 21: 7. [ Links ]
74. Jacques M, Paradis S. Adhesin receptor interactions in Pasteurellaceae. FEMS Microb Rev. 1998; 22: 45-59. [ Links ]
75. Matto S, Miller J, Cotter P. Role of Bordetella bronchiseptica fimbriae in tracheal colonizatton and development of a humoral Immune response. Infecí Immun. 2000; 68: 2024-2033. [ Links ]
76. Foo L, Lu Y, Howell A, Vorsa N. The Structure of Cranberry Proanthocyanidins which Inhibit Adherence of Uropathogenic P-fimbriated E. coli in vitro. Phytochemistry. 2000; 54: 173-183. [ Links ]
77. Mason M, Azizi S, Nogare A. Respiratory epithelial carbohydrate levels of rats with gramnegative bacillary colonization. J Lab Clin Med. 1992; 120 (5): 740-5. [ Links ]
78. Ofek I, Hasty D, Sharon N. MiniReview: Antiadhesion therapy of bacterial diseases: prospects and problems. FEMS Immun Med Microb. 2003; 38: 181-191. [ Links ]
79. Cisar O, Takahashi J, Ruhl S, Donkersloot J, Sandberg A. Specific inhibitors of bacterial adhesion: observations from the study of gram-positive bacteria that initiate biofilm formation on the tooth surface. Adv Dent Res. 1997; 11 (1): 168-175. [ Links ]
80. Sharon N, Ofek I. Fighting infectious diseases with inhibitors of microbial adhesion to host tissues. Crit Rev Food Scien Nutrit. 2002; 42 (Suppl.): 267-272. [ Links ]
81. Aronson M, Medalia O, Schori L, Mirelman D, Sharon N, Ofek I. Prevention of colonization of the urinary tract of mice with Escherichia coli by blocking of bacterial adherence with methyl a-d-mannopyranoside. Lancet Infect Dis. 2010; 10 (9): 597-602. [ Links ]
82. Shi L, Ardehali R, Caldwell K, Valint P. Mucin coating on polymeric material surfaces to suppress bacterial adhesion. Colloids and Surfaces B: Biointerfaces. 2000; 17: 229-239. [ Links ]
83. Bavington C, Page C. Stopping Bacterial Adhesion: A Novel Approach to reating Infections. Respiration. 2005; 72: 335-344. [ Links ]
84. Lehmanna F, Tiralongob E, Tiralongoa J. Review: Sialic acid-specific lectins: occurrence, specificity and function. Cell Mol Life Sci. 2006; 63: 1331-1354. [ Links ]
85. Kahn D, Panariello V, Saeli J, Sampson J, Schwwartz E. Implications for therapy of urinary tract infection and calculi: effect of cranberry juice on urine. J Am Dietetic Assoc. 1967; 51: 251. [ Links ]
86. Weiss E, Lev-Dor R, Kashmamn Y, Goldhar J, Sharon N, Ofek I. Inhibiting interspecies coagregation of plaque bacteria with a cranberry juice contrituent. J Am Dent Assoc. 1998; 129: 1719-1723. [ Links ]
87. Dziva F, Christensen H, van Leengoed L, Mohan K, Olsen J. Differentiation of Pasteurella multocida isolates from cases of atrophic rhinitis in pigs from zimbabwe by rapd and ribotyping. Vet Mic. 2004; 19: 102 (1-2): 117-22. [ Links ]
88. Frost A, Adler B. Pasteurella multocida: the elusive determinants of virulence and immunity. Vetmicrob. 2000; 72: 1-2. [ Links ]
89. Miyoshi S, Hamada H, Miyoshi A, Ito R, Hamaguchi N, Murakami S et ál. Pasteurella multocida pneumonia: Zoonotic transmission confirmed by molecular epidemiological analysis. Japan Geriatrics Society. 2011; 159-163. [ Links ]
90. Digiacomo R, Taylor F, Alien B, Hinton M. Naturally acquiered Pasteurella multocida infection in rabbits: immunological aspeets. Labanim Sci. 1990; 40: 289-292. [ Links ]
91. Borkowska-Opacka B, Rutkowska-Jurga I, Truszynky M. Determination of the serotypes of Pasteurella multocida strains isoiated from rabbit. Bull Vet Ins Pulawy. 1995; 39: 9-12. [ Links ]
92. Mogollón J, Valenzuela S. Inmunidad y patogénesis de las enfermedades respiratorias del cerdo (revisión de literatura). Rev Ceisa. 1995; 2: 104-126. [ Links ]
93. Kawamoto E, Swada T, Maruyama T. Evaluation of transport media for Pasteurella multocida isolates from rabbit nasal specimens. J Clin Microbiol. 1997; 35: 1948-1951. [ Links ]