Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Boletín de Investigaciones Marinas y Costeras - INVEMAR
versión impresa ISSN 0122-9761
Bol. Invest. Mar. Cost. vol.50 supl.1 Santa Marta dic. 2021 Epub 13-Dic-2021
https://doi.org/10.25268/bimc.invemar.2021.50.suplesp.922
Artículos de Investigación
Identificación de florecimientos fitoplanctónicos en el estrecho de Gerlache, Península Oeste Antártica
1Dirección General Marítima. Centro de Investigaciones Oceanográficas e Hidrográficas, Cartagena, Colombia. mcanonpaez@dimar.mil.co
2Facultad de Ciencias Marinas, Universidad Autónoma de Baja California, Ensenada 22860, México; santamaria@uabc.edu.mx
In order to identify phytoplankton blooms, the inherent optical properties index (IOPIndex) was used in surface water samples and the maximum chlorophyll-a (MPC) that were taken in the Third (January 2017) and in the Fourth Expedition (January 2018) from Colombia to Antarctica in the Gerlache Strait (EG). The IOPIndex is calculated from the standardized spatial anomalies of the phytoplankton, detritus and colored dissolved organic matter (CDOM) absorption coefficients using wavelength 443. In addition, the phytoplankton size index was calculated using the Blue / Red ratio and this related to the IOPIndex to determine the size structure of the phytoplankton responsible for the blooms. In 2017, four stations were identified under bloom conditions, where two were superficial blooms and two subsurface bloom; to three in conditions of decrease of the bloom and to twelve in conditions of non-bloom, with a structure of diverse size where populations of the micro, nano and the picophytoplankton predominated. In 2018, two stations were identified in bloom conditions, being one superficial bloom and the other subsurface bloom; to two in conditions of decrease in bloom and nine in conditions of non-bloom, the size structure that dominated the blooms was microphytoplankton. With the IOPIndex, subsurface bloom conditions were observed in both expeditions, also proving their effectiveness for blooms generated by natural or seasonal conditions at different depths of the water column.
KEYWORDS: Absorption coefficients; Inherent optical properties index; Size index; Gerlache Strait; Phytoplankton
Con la finalidad de identificar florecimientos fitoplanctónicos, se utilizó el índice de propiedades ópticas inherentes (POIíndice) en muestras de agua de la superficie y el máximo de clorofila-a (MPC) que fueron tomadas en la Tercera (enero de 2017) y en la Cuarta Expedición (enero 2018) de Colombia a la Antártida en el Estrecho de Gerlache (EG). El POIíndice se calculó partir de las anomalías espaciales estandarizadas de los coeficientes de absorción del fitoplancton, el detritus y la materia orgánica disuelta coloreada (CDOM) usando la longitud de onda 443. Además, se calculó el índice de tamaño del fitoplancton mediante la razón Azul / Rojo y este se relacionó con el POIíndice para determinar la estructura de tamaño del fitoplancton responsable de los florecimientos. En 2017 se identificó a cuatro estaciones en condiciones de florecimiento, siendo dos superficiales y dos subsuperficiales; a tres estaciones en condiciones de descenso del florecimiento y a doce en condiciones de no florecimiento, con una estructura de tamaño diversa donde predominaron poblaciones del micro, nano y del picofitoplancton. En 2018 dos estaciones se identificaron en condiciones de florecimiento, siendo uno superficial y otro subsuperficial; a dos en condiciones de descenso del florecimiento y nueve en condiciones de no florecimiento, la estructura de tamaño que dominó los florecimientos fue el microfitoplancton. Con el POIíndice, se observaron en las dos expediciones condiciones susbsuperficiales de florecimientos, probándose además su efectividad para florecimientos generados por condiciones naturales o estacionales en diferentes profundidades de la columna de agua.
PALABRAS CLAVES: Coeficientes de absorción; Índice Bio-optico de florecimientos fitoplanctónicos; Índice de tamaño; Estrecho de Gerlache; fitoplancton
INTRODUCCIÓN
El fitoplancton marino requiere nutrientes y luz para su crecimiento. En el caso de la luz, la señal es absorbida o dispersada por los componentes presentes en el agua como son: la materia orgánica disuelta coloreada (CDOM); las partículas (fitoplancton y detritus) y el agua de mar ópticamente pura. Según Kirk (2011), a estas propiedades se les conoce como propiedades ópticas y se especifican en términos del coeficiente de absorción o dispersión. Fueron referidas por Preisendorfer (1961) como propiedades ópticas inherentes (POI), porque su magnitud depende solo de las sustancias presentes en el medio acuático y no de la estructura geométrica de los campos de luz que pueden penetrar en la columna de agua (Mobley, 1994; Kirk, 2011). La ciencia que se encarga de estudiarlos es la óptica hidrológica, que es una parte de la física que estudia el comportamiento de la luz en el agua (Kirk, 1994).
Las POI han sido utilizadas en la validación de productos satelitales de color del océano (IOCCG, 2006; Brewin et al., 2015). Estos componentes absorben la luz en diferentes longitudes de onda del espectro electromagnético (Sathyendranath y Morel, 1983), permitiendo diferenciar espectros de absorción que para el caso del agua registra mayor absorción en el rojo, para el CDOM en el ultravioletra-visible y para el material particulado como el fitoplancton en el azul (Aguilar-Maldonado et al., 2018a).
Cambios en el color del océano es posible medirlos a través de técnicas tradicionales (muestreo in situ) (Santamaría-del-Ángel et al., 2015; Aguilar-Maldonado et al., 2018a) o plataformas satelitales (Aguilar Maldonado et al., 2018b; Aguilar-Maldonado et al., 2019). En el caso de los muestreos tradicionales, son escasos los programas de bases de datos de propiedades ópticas (Santamaría-del-Ángel et al., 2015), mientras que los métodos con plataformas satelitales de color del océano, se han preocupado por incorporar nuevos productos para entender las características de absorción, dispersión del agua y sus constituyentes (Aguilar-Maldonado et al., 2019), pese a que en sus inicios las misiones estaban orientadas solamente a la determinación de la concentración de Clorofila-a (Ch-a) en los océanos (Arnone et al., 2006; IOCCG, 2015).
Dentro de los eventos documentados, que cambian el color del océano, están los florecimientos del fitoplancton, los cuales responden a eventos naturales o estacionales y juegan un papel importante en los balances ecológicos locales (Falkowski y Raven, 2007). Cuando un florecimiento ocurre, dependiendo del grupo dominante que lo genera puede cambiar el color desde un verde brillante a rojo o café oscuro (Santamaría-del-Ángel et al., 2015). El color del florecimiento es resultado de los pigmentos contenidos dentro de las celulas del fitoplancton, aunado a otros factores como los sedimentos, la CDOM y cualquier otro compuesto presente en la parcela de agua (Barocio-León et al., 2006).
Los florecimientos fitoplanctónicos es posible caracterizarlos con métodos diferentes a los tradicionales, Santamaría-del-Ángel et al. (2015) propusieron el uso de un índice de POIs para detectar florecimientos en aguas ópticamente complejas. Este POIíndice, se calcula apartir de las anomalias estandarizadas espaciales de los coeficientes de absorción del fitoplancton (aphy), de la materia orgánica disuelta coloreada (aCDOM) y de los detritos (ad), utilizando la longitud de onda (λ) 443 nm. Además, considera el análisis de funciones empíricas ortogonales (Santamaría-del-Ángel et al., 2011) y puede clasificar las estaciones en estado de florecimiento y de no-florecimiento.
En la Antártida los florecimientos se desarrollan desde la primavera hasta el verano austral. Investigaciones realizadas en los 70’s (Holm-Hansen et al., 1989), demostraron que la mayoría de las masas de agua oceánicas antárticas predominaban con bajas biomasas fitoplanctónicas, donde la fracción del microfitoplancton era mucho más baja que las del nanofitoplancton, pero en las zonas costeras esta biomasa aumentaba. Cambios en la composición del fitoplancton en la Península Oeste Antártica (POA), de grandes diatomeas (Rodriguez et al., 2002) a pequeños criptofitos (Mendes et al., 2018) ha generado consecuencias en los niveles tróficos superiores (Mendes et al., 2013). Hasta la fecha, con POI no se ha documentado para esta área condiciones de florecimientos, sino que se han realizado a través de plataformas satélites usando como indicador a la concentración de Chl-a (Gonçalves-Araujo et al., 2015) y bases de datos in situ, con lo cual se detectaron ciclos de cinco años (Kim et al., 2018) en los aumentos de la biomasa del fitoplancton.
Por lo anterior, el objetivo de este trabajo fue caracterizar florecimientos del fitoplancton en el EG mediante el POIíndice propuesto por Santamaría-del-Ángel et al. (2015). Para esto se consideraron estaciones superficiales y en el MPC en 2017 y en 2018, cada año y profundidad fueron considerados por separado. Además, se relacionó el POIíndice con la estructura de tamaño (picofitoplacton, nanofitoplancton o microfitoplancton), para identificar la fracción de tamaño del fitoplancton responsable de los florecimientos, aspecto hasta la fecha no abordado en esta área geográfica de estudio.
ÁREA DE ESTUDIO
El EG está localizado en la zona costera de la Península Oeste Antártica y al norte del Archipiélago de Palmere (García et al., 2002; Varela et al., 2002), es una cuenca poco profunda limitada al oeste por las islas Anvers y Brabant y al este con la Península Antártica Norte. Está conectado al norte con el Estrecho de Bransfield y al mar de Bellingshausen a través de dos canales estrechos, en el centro por el canal de Schollaert y en el sur por el de Bismarck (Kerr et al., 2018). Se consideran que es una extensión en dirección oeste de la Cuenca Occidental del Estrecho de Bransfield (García et al., 2002; Rodríguez et al., 2002) (Fig. 1).
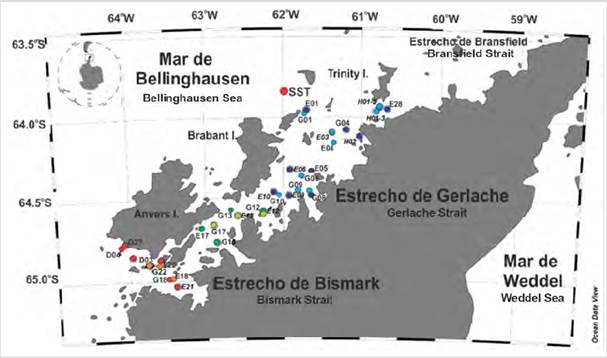
Figura 1 Distribución de las estaciones en el Estrecho de Gerlache. La región sur estuvo representada por las estaciones de círculos rojos (2017) y naranjas (2018), la región central por los círculos verde oscuro (2017) y verde claro (2018) y la región norte por los círculos azules (2017) y morados (2018).
Estudios de circulación (Doval et. al., 2002; Zhou et al., 2002; Sagra et al., 2011) en el EG indican la incidencia de masas de agua de los Mares de Weddell, Bellingshausen y el Drake. Las masas de agua que predomina son aguas zonales transicionales con influencia del Mar de Bellingshausen (TBW) que fluyen a través de diferentes vías como el Estrecho de Bismark y Dalman a través de la Bahía del Canal de Shorlaert y aguas zonales transicionales con influencia del Mar de Weddell (TWW) (García et al., 2002). La circulación en la superficie varía según la estación, con un patrón principal de salida hacia el Norte (Zou et al., 2002) que se une al flujo de la Corriente de Bransfield, corriente de límite occidental que se mueve hacia el Noreste cerca de las Islas Shetland del Sur (Sagra et al., 2011).
MATERIALES Y MÉTODOS
Muestras de agua en la superficie y el máximo de Chl-a (MPC), profundidad a la que ocurre la mayor concentración de Chl-a, se recolectaron a través de un sistema de roseta oceanográfica de 12 botellas de 8 L cada una. Perfiles de fluorescencia se tomaron en las estaciones para identificar el MPC con un fluorímetro ECOtriplet acoplado a un CDT SB19 Plus. Estas muestras fueron tomadas durante la Tercera (enero de 2017) y Cuarta Expedición (enero de 2018) de Colombia a la Antártida (Fig. 1) en el EG, en el marco del Proyecto: Investigación científica marina para la seguridad marítima en la Antártica” a cargo de la Dirección General Marítima.
Entre 1 a 2 L de agua se filtraron a través de filtros GF / F, con un sistema de filtración positiva, para determinar los coeficientes de absorción por el material particulado (a P(λ)), de acuerdo con Mitchell et al. (2002). Los filtros se guardaron en cápsulas histoprep y en nitrógeno líquido hasta análisis en laboratorio. Adicionalmente, se tomaron muestras de 250 mL de agua, en botellas ámbar previamente tratadas con HCL al 10 % y mufladas a 450 °C, para determinar el a CDOM (λ) según Mitchell et al. (2002).
En el laboratorio, para la determinación del a P(λ) los filtros se humedecieron con una gota de agua de mar filtrada y su densidad óptica (OD) se leyó entre 400 a 700 nm con incrementos de 1 nm, a través de un espectrofotómetro Varian-Cary 100 con un sistema de esfera integradora siguiendo el protocolo de Mitchell et al. (2002). El procedimiento de lectura, se repitió después de enjuagar los filtros dos veces, con metanol caliente por 15 minutos, para obtener el coeficiente de absorción del detritus a d(λ). El coeficiente de absorción del fitoplancton a Phy(λ) se obtuvo por la diferencia entre el a P (λ) y el a d (λ).
Para la determinación del a CDOM (λ), las muestras de agua, se filtraron a través de filtros de membrana de 0.25 mm de poro y la densidad óptica del filtrado se leyó entre 250 a 750 nm, usando celdas de 10 cm de longitud. La determinación a CDOM (λ) se realizó de acuerdo con Mitchell et al. (2002).
Para identificar el estado del florecimiento de las estaciones muestreadas en el EG, se calculó el POIíndice para estaciones en superficie-2017, en el MPC-2017, en superficie-2018 y en el MCP-2018 de acuerdo con Santamaría-del-Ángel et al. (2015), cuyo proceso implicó: 1) estandarizar los valores del a Phy (443), a CDOM (443) y a d(443), mediante la transformación Z; 2) realizar el análisis de componente principales para reducir el número de variables; 3) elegir el primer ACP debido a que representa la mayor variación posible del conjunto de datos basándose en los valores propios (eigenvalores) y 4) calcular el índice con base en la primera función empírica ortogonal estandarizada (SEOF1) (Santamaría-del-Ángel et al., 2011) mediante:
Donde Z corresponde a las anomalías espaciales estandarizadas por condición (superficie 2017, MPC 2017, superficie 2018 y MPC 2018) de las absorciones de a Phy (443), a CDOM (443), y a d (443) respectivamente y los coeficientes b 1,1 , b 1,2 , y b 1,3 a los pesos de las anomalías. Para describir el estado del florecimiento, se consideró el criterio de Santamaría-del-Ángel et al. (2015), quienes indican que en una distribución gaussina, un intervalo de confianza a un 95 % tiene limite superiores de 1.96 desviaciones estándar (valor de Z ). Este valor fue redondeado a 2 desviaciones estándar para definir el límite de las condiciones de florecimiento. Mientras mayor sea este valor el florecimiento será más intenso. Con base en lo anterior, Aguilar-Maldonado et al. (2018 b), para describir las etapas de un florecimiento de fitoplancton, interpretaron los valores del POIíndice definiendo valores, < que 1, la estación esta en condiciones de no florecimiento; valores entre 1 y 2 representan condiciones en las que la estación esta a punto de entrar en condiciones de florecimiento o que ya va saliendo de un florecimiento y los valores superiores a 2 son anómalos e indican condiciones de florecimiento activo.
De otro lado, con el a Phy (λ), también es posible determinar el índice de tamaño de la población de fitoplancton dominante (Wu et al., 2007; Millan-Nuñez y Millan-Nuñez, 2010) en los cruceros, mediante la razón:
Con la razón Azul / Rojo fue posible identificar la fracción de tamaño de la población de fitoplancton responsable del florecimiento al relacionarla con el POIíndice. Según, Wu et al. (2007), una proporción de Azul / Rojo mayor que 3.0 implica el predominio de picofitoplancton y valores menores a 2.5 de microfitoplancton, por lo que el intervalo entre 2.5 y 3.0 predominaría el nanofitoplancton (Santamaría-del-Ángel et al., 2015).
RESULTADOS Y DISCUSIÓN
La ventaja de utilizar este índice, es que no depende del número de observaciones, por tanto, es un buen método para comparar campañas de investigación que tienen diferente número de muestras (Santamaría-del-Ángel et al., 2015). Para el 2017 el POIíndice (Figs. 2a, 2b) mostró a cuatro estaciones en condiciones de florecimiento, a tres en condiciones de entrada o salida del florecimiento y a doce en condiciones de no florecimiento. Estudios previos (Holm-Hansen et al., 1989; Figueroa, 2002; Rodriguez et al., 2002), indicaron que es un área altamente productiva, con una amplia variación espaciotemporal de producción del fitoplancton, debido al aumento de la estabilidad en la capa superficial como consecuencia del aporte glaciar. Lo anterior, aunado a procesos de mezcla reducidos por la geomorfología protegida de esta área, conlleva que se generen florecimientos del fitoplancton (Varela et al., 2002) que sostiene a los todos los niveles tróficos superiores. Así mismo, esta alta productividad se atribuye entre otros factores al patrón complejo de circulación, a la dinámica del hielo, a la entrada de agua continental y a las distintas masas de agua que en este convergen (Kerr et al., 2018).

Figura 2 Relación del Índice de POIíndice con la estructura de tamaño para identificar florecimientos en Estaciones: a. superficiales 2017, b. en el MPC en 2017.
Las estaciones identificadas en estado de florecimiento, en la superficie de 2017, fueron la D04 ubicada en la Estación Palmer al sur del EG y la estación G16 también ubicada en el Sur del Estrecho (Fig. 2a). Para esta condición, el diagrama de dispersión del POIíndice vs la razón Azul / Rojo mostró que la estructura de tamaño que conformó el florecimiento en estas dos estaciones fue el microfitoplancton (Fig. 2a). Los trabajos de Rodriguez et al. (2002) y Varela et al. (2002), para áreas costeras del EG, describieron que ocurre una amplia variación espaciotemporal de producción del fitoplancton junto con altas concentraciones de Chla y dominio de las diatomeas (Mendes et al., 2013; Gonçalves-Araujo et al., 2015;), con lo cual se sigue manteniendo estructuras de tamaño del microfitoplancton según la aproximación del POIíndice.
La magnitud del espectro de absorción de las estaciones en florecimiento fue posible compararlas a través del cálculo del espectro adimensional (A) según los criterios de Barocio-Leon et al. (2006). Con el espectro A, se eliminan las diferencias en la magnitud de los espectros generadas por la concentración de clorofila de cada muestra. Por lo anterior, cada valor de absorción entre 400 a 700 nm fue estandarizado por el valor máximo de absorción de este intervalo. En el caso de la estación D04 no se observó un hombro pronunciado entre 480 a 500 nm (Fig. 3b), estas diferencias en la forma se atribuyen a variaciones en la concentración y composición de pigmentos presentes en la célula (Babin et al., 2003) o al efecto paquete, por el tamaño celular (Wright y Jeffrey, 2006).

Figura 3 Coeficientes de absorción del fitoplancton y espectro normalizado (adimensional), donde las Estaciones superficiales 2017: G16 (verde), D04 (Azul) en florecimiento se representan en a. Espectro de aphy, b. espectro Adimensional y para las estaciones en florecimiento en el MPC en 2017: G04 (amarillo), H01-3 (magenta) se representan en c. Espectro de aphy y d. espectro Adimensional.
Datos de cromatografía liquida de alta resolución (HPLC, Thomas et al., 2012) mostraron que en la estación G16, la concentración más alta de pigmentos, fue la fucoxantina pigmento marcador de las diatomeas (Roy et al., 2011), mientras que, en la estación D04, se observaron concentraciones similares de fucoxantina, hexfucoxantina y en menor proporción, de alloxantina (Fig. 4). Lo anterior, evidencia un cambio en la concentración de pigmentos y, por lo tanto, en la composición de la estructura fitoplanctónica (Sathyendranath et al., 2001; Cañon-Páez, 2020) en estas dos estaciones en florecimiento activo. Así mismo, en la región entre 550 y 650 nm (Fig. 3b) la absorción es menor y con hombros no observados en la estación G16, estas formas son características de grupos con la presencia de pigmentos carotenoides (Wright et al., 1991).
Por el contrario, la estación G08 en la superficie de 2017, ubicada en la región norte del Estrecho, se identificó en condición de florecimiento del picofitoplancton (Fig. 2a), pero aparentemente va en condiciones de salida. Este resultado, deja ver una ventaja del método, en cuanto a que con el POIíndice es posible identificar si una estación está o no en condiciones de florecimiento, además permite identificar florecimientos ocasionados por los diferentes tamaños del fitoplancton, lo cual no es posible observar con métodos tradicionales como la observación al microscopio.
En las estaciones del MPC en 2017, el POIíndice mostró a la estación G04, en estado de florecimiento ocasionado por microfitoplacton (Fig. 2b), mientras que en la estación H01-3 se mostró también en florecimiento, pero de nanofitoplancton (Fig. 2b). Aspecto importante de resaltar, dado que el reporte de florecimientos para fracciones como el nano o picofitoplancton son escasos, debido a las limitaciones del método tradicional de observar fracciones pequeñas (Santamaría-del-Ángel et al.,2015). Para las estaciones identificadas en condiciones de entrada o salida del florecimiento, que fueron dos, en la H01-2 la fracción responsable fue el picofitoplancton y en la H02 el nanofitoplancton, las demás se presentaron en condiciones de no florecimiento (Fig. 2b). Sin embargo, valores bajos de CDOM para las estaciones H01-2 y H02 (0.02 y 0.03 m-1) indican que la condición para estas estaciones es de entrada en florecimiento.
Un aspecto a observar, es que las estaciones G04 y H01-3, fueron identificadas en superficie como estaciones de no florecimiento, lo cual constituye otra ventaja de este método, pues permite identificar condiciones de florecimiento en profundidad o florecimientos subsuperficiales. Además, este resultado sugiere que durante el 2017 la superficie no estuvo interconectada con el MPC, actuando de manera independiente cada una. Lo anterior, sugiere un alto aporte glaciar con mayor estratificación en la columna de agua, producto del incremento del agua de deshielo de un año cálido (Kim et al., 2018), que hace que la estabilidad en la capa superficial aumente como consecuencia del aporte glaciar y aunado a procesos de mezcla reducidos (Varela et al., 2002), conlleva que se generen florecimientos del fitoplancton independientes.
Si se observa la magnitud de los espectros aphy, de las estaciones G04 y H01-3 en el MCP en 2017 (Fig. 3c) son más aplanados, con respecto los espectros de las estaciones en florecimiento (G16, D04) en la superficie en 2017 (Fig. 3a). La explicación a este aplanamiento, puede ser debido a la adaptación de las comunidades del fitoplancton a procesos de fotoaclimatación, o por el efecto paquete, que es característico de comunidades con tamaños de células más grandes (Bricaud et al., 1995) y que generalmente son evidenciados por el aplanamiento del espectro de absorción. Tanto la fotoaclimatación como el efecto paquete hacen que las comunidades del fitoplancton regulen el contenido de pigmentos en la célula en respuesta a la disponibilidad de luz (MacIntyre et al., 2002) provocando un cambio en la forma (Fig. 3d) del espectro (Bricaud et al., 2004).
Aunado a lo anterior, en la Figura 4, se observa que, la concentración de pigmentos difiere en las estaciones de la superficie y el MPC, aspecto que también influye en el cambio de la forma de los espectros (Fig. 3d). Por lo tanto, a diferencia de la superficie en el MPC, las estaciones en florecimiento presentaron estructuras de tamaños y composición de pigmentos diferentes que muestran cambios en la estructura fitoplanctónica causantes de los florecimientos (Cañon-Páez, 2020).

Figura 4 Porcentaje de contribución de los pigmentos fucoxantina (Fuco), peridinina (Per), butanoiloxifucoxantina (But), hexanoiloxifucoxantina (Hex), alloxantina (Allo), clorofila b (Chl-b), en las estaciones en florecimiento donde: 2017 en superficie (G16, D04) y MPC (H01-3, G04); 2018 en superficie (E18) y en MPC (E17).
Las formas adimensionales presentadas en las estaciones G04 y H01-3 (Fig. 3d) no presentaron diferencias en el hombro entre 480 y 500 nm, siendo muy parecidos, sin embargo, la magnitud de la absorción entre 500 a 650 nm fue menor para la estación H01-3. Este cambio puede ser producto de la presencia de Allo, pigmento asociado junto con la Hex al nanofitoplancton (Vidussi et al., 2001). Por lo tanto, se sugiere que, en el MPC, el cambio en la forma de los espectros obedeció al tamaño celular que influye en el efecto paquete (Bricaud et al., 2004), a procesos de fotoaclimatación (Ciotti et al., 2002; Barocio-León et al., 2006;) y a las diferencias en las proporciones de pigmentos fitoplanctónicos presentes en las comunidades presentes en las estaciones en florecimientos.
En cuanto a los datos de 2018 solamente dos estaciones (E18, E17) se identificaron en condiciones de florecimiento, dos en condiciones de entrada o salida del florecimiento (E05, E06) y nueve en condiciones de no florecimiento (E13, E04, E01, E03, E10, E28, E22, E08, E09) (Figs. 5a y 5b). De las estaciones identificadas en florecimiento en la superficie, solamente la E18 se observó en florecimiento de microfitoplancton (Fig. 5a). Las estaciones E17, E05 y E06 se identificaron en condiciones de entrada o salida del florecimiento también con predominio del microfitoplancton.
Las estaciones E17 y E05 en la superficie en 2018, estuvieron cerca del límite inferior para ser considerados en condiciones de florecimiento, con un valor de 1.9 (Fig. 5a), por lo cual se pensaría, que esta estación está en proceso de iniciar un florecimiento o recién viene saliendo de él. Para identificar si el florecimiento está iniciando o está en decaimiento, se esperaría encontrar altos valores de aCDOM (443) si fuera la segunda opción, ya que según Aguilar-Maldonado et al. (2018a) una fuente de CDOM es un florecimiento, lo constituyen el fitoplancton en procesos de descomposición, asociado a la etapa más intensa del florecimiento previo. También se ha reportado que, otras fuentes de CDOM en aguas antárticas son el bacterioplancton y el Krill (Ortega-Retuerta et al., 2010; 2009). En el caso de las estaciones E17 y E05, presentaron valores de CDOM de 0.12 m-1 (que representa una anomalía estandarizada Z=-0.87) y de 0.25 m-1 (Z=1.14), respectivamente. Estos valores sugieren que la estación E05 se encuentra en la fase de decaimiento del florecimiento, mientras que en la estación E17 está iniciando.

Figura 5 Relación del Índice de POIíndice con la estructura de tamaño para identificar florecimientos en Estaciones: a. superficiales 2018, b. en el MPC en 2018.
La estación E18 mostró al aphy (λ), por debajo de 0.2 m-1 (Fig. 6a) y su forma adimensional (Fig. 6b) dejo ver un hombro pronunciado en la región 480 a 500 nm, el cual no se observó en las estaciones en florecimiento del 2017. Este hombro es característico de poblaciones con presencia de Allo y Hex (Cota et al. 2003) con lo cual se generan cambios en el espectro de absorción de esta estación con respecto a las de 2017. En la Figura 4 se pueden observar contribuciones altas de Chl-b para esta estación, pigmento no observado en las estaciones en florecimiento en 2017 y el cual es considerado marcador de las clorofitas (Roy et al., 2011). Por la alta concentración de este pigmento se pensaría según Vidusii et al. (2001) que la fracción de tamaño responsable del florecimiento sería el nanofitoplancton, sin embargo, la Razón Azul / Rojo propuesta por Wu et al. (2007), dejo ver con el índice que corresponde al microfitoplancton. Con esta estación, además fue posible observar el cambio en la estructura de la comunidad del fitoplancton en el EG entre 2017 y 2018, observados en la forma de los espectros (Figs. 3 y 5), los cuales pueden estar asociados a diferentes respuestas fisiológicas de las comunidades por factores ambientales (Gonçalves-Araujo et al., 2015) y ecológicos, entre ellos a diferentes grados de empaquetamiento de pigmento (Ferreira et al., 2018).

Figura 6 Coeficientes de absorción del fitoplancton y Adimensional, para las estaciones en florecimiento en 2018: Superficial de la E18 (Azul) se representan en a. Espectro de aphy, b. Espectro Adimensional y parael MPC de la E17 (magenta) se representan en c. Espectro de aphy y d. espectro Adimensional.
De otro lado, en las estaciones del MPC en 2018 la estación E17, alcanzó un valor de POIíndice de 5 (desviaciones estándar) mostrando a esta estación en un estado de florecimiento muy intenso, ocasionado por microfitoplancton (Fig. 5b). Lo anterior, confirma que esta estación en la superficie no estaba en salida del florecimiento sino en entrada, esto debido al valor del POIíndice registrado para el MCP y a los bajos valores de CDOM. La estación E18 por el contrario, por el valor del POIíndice para el MPC indicaría la condición de salida del florecimiento debido el aumento del valor del CDOM (0.22 m-1) con respecto a la superficie (0.18 m-1).
Con la estación E17 y la E18 se evidencia una interconexión entre la superficie y el MCP en 2018 no identificado en 2017, donde las estaciones en florecimiento en el MPC fueron diferentes a las de la superficie, sugiriendo menos aporte glacial, con lo cual la estratificación en la columna de agua fue menor y la interconexión fue más evidente. Por tanto, se sugieren mayores procesos de mezcla en 2018 que conllevan capas interconectadas entre la superficie y el MPC no independientes como en 2017. Además, la estación E17 presentó el espectro de absorción con las mayores magnitudes de absorción, notándose un hombro pronunciado entre 450 y 500 nm (Fig. 6c) y en la forma adimensional la forma es muy parecida a la E18 en superficie, sin embargo, el hombro es más pronunciado en la E17. La diferencia, obedece a la presencia de otros pigmentos en la E18 (Fig.4) como la Allo y Hex. En la E17, la Chl-b fue el pigmento con la mayor concentración, por lo cual se cree que el grupo con mayor contribución al florecimiento en esta estación estaría dado por los flagelados verdes (clorofitas) y no por las diatomeas (Mendes et al., 2012) que sí estuvieron presentes en 2017 por la contribución de fucoxantina como lo deja ver la Figura 4.
Las diferencias observadas en las estructuras de la comunidad, responsables de los florecimientos en 2018 con respecto al 2017, puede obedecer a la variabilidad ambiental ya identificada por Saba et al., (2014) y Kim et al. (2018) para la POA, donde ciclos de alta concentración de clorofila se observa cada 5 años, siendo el 2017 un año con alta biomasa (1.22 mg/m3 Chl-a y 1.42 mg/m3 Chl-a, en superficie y el MPC) y 2018 se identificó como el inicio del periodo en descenso de la biomasa (0.63 y 0.70 mg/m3 Chla en superficie y el MPC).
CONCLUSIONES
En este trabajo a través del POIíndice fue posible identificar florecimientos superficiales y subsuperficiales (en las estaciones H01-3, G04 y E17 del MPC) en el EG, observándose cambios en las condiciones estudiadas, donde en 2017 no fue posible observar una interconexión entre las estaciones superficiales y el MPC, mientras que en 2018 sí. Los cambios observados en las formas de los espectros de absorción, mostraron diferencias en la estructura fitoplanctónica, debido a la estructura de tamaño, la composición de pigmentos diferentes y las condiciones ambientales cálidas (2017) y frías (2108). Esta aproximación permitió identificar florecimientos de pico y nanofitoplancton que a través del método tradicional no es posible observar, debido a que estas estructuras de tamaño no son identificables en el microscopio óptico tradicional. Lo anterior hace que esta herramienta sea un complemento muy importante en los programas de monitoreo donde el componente fitoplanctónico sea considerado.
AGRADECIMIENTOS
A la Dirección General Marítima por el apoyo y financiación para el desarrollo del proyecto. A la Armada Nacional y el Programa Antártico Colombiano por lo cupos en la III y IV Expedición a la Antártida. A la Facultad de Ciencias Marinas de la Universidad Autónoma de Baja California por la aceptación al programa de doctorado, al CONACYT por proveer los recursos de la beca doctoral No CUV / Becario 208078 / 633423 y AMERIGEOSS por el apoyo financiero de materiales.
REFERENCIAS
Aguilar-Maldonado, J., E., Santamaría-del-Ángel, A., González-Silvera, O., Cervantes-Rosas, L., Lopez, A., Gutiérrez-Magness, S., Cerdeira-Estrada and M.T, Sebastiá-Frasquet. 2018a. Identification of Phytoplankton Blooms under the Index of Inherent Optical Properties (IOP Index) in Optically Complex. Water., 10(2): 1-17. https://doi.org/10.3390/w10020129 [ Links ]
Aguilar-Maldonado, J.A., E., Santamaría-Del-Ángel, A., González-Silvera, O.D., Cervantes-Rosas and M.T., Sebastiá-Frasquet. 2018b. Mapping satellite inherent optical properties index in coastal waters of the Yucatán Peninsula (Mexico). Sustainability, 10(6): 1-20. https://doi.org/10.3390/su10061894 [ Links ]
Aguilar-Maldonado, J., E., Santamaría-del-Ángel, A., González-Silvera and, M.T, Sebastiá-Frasquet. 2019. Detection of Phytoplankton Temporal Anomalies Based on Satellite Inherent Optical Properties: A Tool for Monitoring Phytoplankton Blooms. Sensors, 550401. https://doi.org/10.3390/s19153339 [ Links ]
Arnone, R., M., Babin, A.H., Barnard, E., Boss, J.P., Cannizzaro, K.L., Carder, F.R., Chen, E., Devred, R., Doerffer, K., Du F., Hoge, O.V., Kopelevich, T., Platt, A., Poteau, C., Roesler and S., Sathyendranath. 2006. Reports of the International Ocean-Colour Coordinating Group Remote Sensing of Inherent Optical Properties: Fundamentals, Tests of Algorithms, and Applications. Dartmouth, Canada. 122p. [ Links ]
Babin, M., D., Stramski, G. M., Ferrari, H., Claustre, A., Bricaud, G., Obolensky, and N., Hoepffner. 2003. Variations in the light absorption coefficients of phytoplankton, nonalgal particles, and dissolved organic matter in coastal waters around Europe, J. Geophys. Res., 108(C7): 3211. https://doi.org/10.1029/2001JC000882 [ Links ]
Barocio-León OA, R., Millán-Núñez, E., Santamaría-del-Ángel, A., González-Silvera and C.C., Trees. 2006. Spatial variability of phytoplankton absorption coefficients and pigments off Baja California during November 2002. J. Oceanogr., 62: 873-885. https://doi.org/10.1007/s10872-006-0105-z [ Links ]
Brewin J.W., S., Sathyendranath, D., Müller, C., Brockmannd, P.Y., Deschamps, E., Devred, R., Doerffer, N., Fomferra, B., Franz, M., Grant, S., Groom, A. Horseman, Ch. Hu, H. Krasemann, Z.P. Lee, S. Maritorena, F. Mélin, M. Peters, P., Platt, P., Regner, T., Smyth, F., Steinmetz, J., Swinton, J., Werdell, and G.N.,White. 2015. The Ocean Colour Climate Change Initiative: III. A round-robin comparison on in-water bio-optical algorithms. Remote Sensing of Environment, 162: 271-294. https://doi.org/10.1016/j.rse.2013.09.016 [ Links ]
Bricaud, A., M., Babin, A., Morel, and H., Claustre. 1995. Variability in the chlorophyll-specific absorption coefficients of natural phytoplankton: Analysis and parameterization, J. Geophys. Res., 100: 13,321- 13,332. https://doi.org/10.1029/95JC00463 [ Links ]
Bricaud, A., H., Claustre, J., Ras and K.,Oubelkheir. 2004. Natural variability of phytoplanktonic absorption in oceanic waters: Influence of the size structure of algal populations. J. Geophys. Res., 109: C11010. https://doi.org/10.1029/2004JC002419 [ Links ]
Cañón-Paez, M L. . 2020. Delimitación de regiones dinámicas en el Estrecho de Gerlache- Península Oeste Antártica, con base en una aproximación multisensor: Descripción de su variabilidad hidrográfica, química, biológica y óptica (tesis de doctorado). Universidad Autonoma de Baja California, México. [ Links ]
Ciotti, A.M., M.R., Lewis and J.J., Cullen. 2002. Assessment of the relationships between dominant cell size in natural phytoplankton communities and the spectral shape of the absorption coefficient. Limnol. Oceanogr., 47(2): 404-417. https://doi.org/10.4319/lo.2002.47.2.0404 [ Links ]
Cota, G.F., G. Harrison, T. Platt, S., Sathyendranath and V., Stuart. 2003. Bio-optical properties of the Labrador Sea. J. Geophys. Res. 108: 3228. https://doi.org/10.1029/2000JC000597 [ Links ]
Doval, M.D; X., Alvarez-Salgado, C., Castro and F., Perez. 2002. Dissolved organic carbon distributions in the Bransfield and Gerlache Straits, Antarctica. Deep-Sea Research II, 49: 663-674. https://doi.org/10.1016/S0967-0645(01)00117-5 [ Links ]
Falkowski, P.G., and J., Raven. 2007. Aquatic Photosynthesis, second edition. Princeton University Press. Princeton, USA. 476p. https://doi.org/10.1515/9781400849727 [ Links ]
Figueroa, L., 2002. Bio-optical characteristics of Gerlache and Bransfield Strait waters during an Antarctic summer cruise. Deep-Sea Research II. 49: 675-691. https://doi.org/10.1016/S0967-0645(01)00118-7 [ Links ]
García M., C., Castroc, A., Ríos, M., Doval, G., Rosón, D., Gomise and López ,O. 2002. Water masses and distribution of physico-chemical properties in the Western Bransfield Strait and Gerlache Strait during Austral summer 1995/96. Deep-Sea Research II. 49: 585-602. https://doi.org/10.1016/S0967-0645(01)00113-8 [ Links ]
Gonçalves-Araujo R., M., Silva de Souza, V., Tavano and C., Eiras. 2015. Influence of oceanographic features on spatial and interannual variability of phytoplankton in the Bransfield Strait. J. Marine. Syst., 142: 1-15. https://doi.org/10.1016/j.jmarsys.2014.09.007 [ Links ]
Holm-Hansen, O., B.G., Mitchell and D.M., Karl. 1989. Phytoplankton blooms in the vicinity of Palmer Station, Antarctica. Polar Biol., 10(1): 49-57. https://doi.org/10.1007/BF00238290 [ Links ]
IOCCG. 2014. Phytoplankton Functional Types from Space. Sathyendranath, S. (ed.), Reports of the International Ocean-Colour Coordinating Group, No. 15, IOCCG, Dartmouth, Canada. [ Links ]
IOCCG. 2015. Ocean Colour Remote Sensing in Polar Seas. Babin, M., K. Arrigo, S. Bélanger and M-H. Forget, (eds.). IOCCG Report Series, No. 16, International Ocean Colour Coordinating Group, Dartmouth, Canada. [ Links ]
IOCCG. 2006. Remote Sensing of Inherent Optical Properties: Fundamentals, Tests of Algorithms, and Applications. Lee, Z.-P. (ed.), Reports of the International Ocean-Colour Coordinating Group, No. 5, IOCCG, Dartmouth, Canada. 122 p. [ Links ]
Kerr, R., I.B.M., Orselli, J.M., Lencina-Avila, R.T., Eidt, C.R.B., Mendes, L.C., da Cunha, C., Goyet, M.M., Mataand V.M., Tavano 2018. Carbonate system properties in the Gerlache Strait, Northern Antarctic Peninsula (February 2015): I. Sea-Air CO2 fluxes. Deep-Sea Res. PTII., 149: 171-181. https://doi.org/10.1016/j.dsr2.2017.02.008 [ Links ]
Kim, H., H.W., Ducklow, D., Abele, E.M., Ruiz Barlett, A.G., Buma, M.P., Meredith, P.D., Rosema, O.M., Schofield, H.J., Venables and I.R. Schloss. 2018. Inter-decadal variability of phytoplankton biomass along the coastal West Antarctic Peninsula. Phil. Trans. R. Soc. A 376: 20170174. https://doi.org/10.1098/rsta.2017.0174 [ Links ]
Kirk, J.T.O. 1994. Light and Photosynthesis in Aquatic Ecosystems. University Press, Cambridge. 500 p. https://doi.org/10.1017/CBO9780511623370 [ Links ]
Kirk, J.T.O. 2011. Light and photosynthesis in aquatic ecosystems. 3er edition. Cambridge University Press, Cambridge. 649p. [ Links ]
MacIntyre H.L., T.M., Kana, J., Anning and R. Geider. 2002. Photoaclimation of photosynthesis irradianceresponse curves and photosynthetic pigments in microalgae and cyanobacteria. Journalof Phycology, 38:17-38. https://doi.org/10.1046/j.1529-8817.2002.00094.x [ Links ]
Matsuoka, A., V., Hill, Y. Huot, M., Babin and A., Bricaud, 2011. Seasonal variability in the light absorption properties of western Arctic waters: Parameterization of the individual components of absorption for ocean color applications. Journal of Geophysical Research: Oceans, 116(C2): 1-15. https://doi.org/10.1029/2009JC005594 [ Links ]
Mendes, C.R.B., M.S., de Souza, V.M.T., Garcia, M.C., Leal, V., Brotas and C.A.E., Garcia. 2012. Dynamics of phytoplankton communities during late summer around the tip of the Antarctic Peninsula. Deep-Sea Res. PTI., 65: 1-14. https://doi.org/10.1016/j.dsr.2012.03.002 [ Links ]
Mendes, C.R.B., V.M., Tavano, M.C., Leal, M.S., de Souza, V., Brotas and C.A.E., Garcia. 2013.Shifts in the dominance between diatoms and cryptophytes during three late summers in the Bransfield Strait (Antarctic Peninsula). Polar Biol., 36(4): 537-547.https://doi.org/10.1007/s00300-012-1282-4 [ Links ]
Mendes, C.R.B., VM., Tavano, T. S., Dotto, R., Kerr, M.S., de Souza, C.A.E., Garcia and E.R., Secchi. 2018. New insights on the dominance of cryptophytes in Antarctic coastal waters: A case study in Gerlache Strait. Deep Sea Research Part II: Topical Studies in Oceanography., 149: 161-170. https://doi.org/10.1016/j.dsr2.2017.02.010 [ Links ]
Millán-Nuñez, E. and R., Millán-Nuñez. 2010. Specific Absorption Coefficient and Phytoplankton Community Structure in the Southern Region of the California Current during January 2002. J. Oceanogr., 66: 719-730. https://doi.org/10.1007/s10872-010-0059-z [ Links ]
Mitchell, B.G., M.Kahru, J., Wieland and M., Stramska, 2002. Determination of spectral absorption coefficients of particles, dissolved material and phytoplankton for discrete water samples. In: Mueller JL, Fargion GS, McClain, R (eds) Ocean Optics protocols for Satellite Ocean Color Sensor Validation, Revision 4, Volume IV: Inherent Optical Properties: Instruments, Characterizations, Field Measurements and Data Analysis Protocols. NASA/TM-2003-211621, NASA Goddard Space Flight Center. Greenbelt, MD. (Chapter 4), 39-60. Palma, E.D., Matano, R.P., 2012. A numerical study of the Mage. [ Links ]
Mobley, C.1994. Light and Water: radiative transfer in natural waters. Academic Press, New York. [ Links ]
Ortega-Retuerta, E., T.K., Frazer, C.M., Duarte, S., Ruiz-Halpern, A., Tovar-Sanchez, J.M., Arrieta and I., Reche. 2009. Biogeneration of chromophoric dissolved organic matter by bacteria and krill in the Southern Ocean. Limnology and Oceanography., 54(6): 1941-1950. https://doi.org/10.4319/lo.2009.54.6.1941 [ Links ]
Ortega-Retuerta, E., I. Reche, E., Pulido-Villena, S., Agustí and C.M., Duarte. 2010. Distribution and photoreactivity of chromophoric dissolved organic matter in the Antarctic Peninsula (Southern Ocean). Mar. Chem., 118: 129-139. https://doi.org/10.1016/j.marchem.2009.11.008 [ Links ]
Preisendorfer, R.W. 1961. Application of Radiative Transfer Theory to Light Measurements in the Sea. Union Geod. Geophys. Inst. Monogr., 10: 11-30. [ Links ]
Rodriguez, F., M., Varela and M., Zapata. 2002. Phytoplankton assemblages in the Gerlache and Bransfield Straits (Antarctic Peninsula) determined by light microscopy and CHEMTAX analysis of HPLC pigment data. Deep-Sea Res. PTII., 49(4-5): 723-747. https://doi.org/10.1016/S0967-0645(01)00121-7 [ Links ]
Roy., S., C., Llewellyn, E., Skartad and G., Johnsen. 2011. Phytoplankton pigments.Characterization, Chemotaxonomy and Applications in Oceanography. Cambridge environmental chemistry series. Published in the United States of America by Cambridge University Press, New York. 892 p. ISBN 978-1-107-00066-7. [ Links ]
Saba, G.K., Fraser, W.R., Saba, V. S., Lannuzzi, R.A., Coleman, K.E., Doney, S.C., Ducklow, H., Martison, D., Miles, T.N., Patterson-Fraser, D., Stammerjohn, S.E. 2014. Winter and spring controls on the summer food web of the coastal West Antarctic Peninsula. Nature Communications, Nature communications, 5(1), 1-8. https://doi.org/10.1038/ncomms5318 [ Links ]
Sangra, P., C., Gordo, M., Hernández-Arencibia, A., Marrero-Díaz, A., Rodríguez-Santana, A., Stegner, A., Martítez-Marrero, J.L., Pelegrí and T. Pichon. 2011. The Bransfield current system. Deep Sea Res. Part I: Ocean. Res. Pap. 58 (4): 390-402. https://doi.org/10.1016/j.dsr.2011.01.011 [ Links ]
Santamaría-del-Ángel, E., A., González-Silvera, R., Millán-Nuñez, M.E., Callejas-Jiménez and Cajal-Medrano, R. 2011. Determining Dynamic Biogeographic Regions using Remote Sensing Data. In Handbook of Satellite RemoteSensing Image Interpretation: Applications for Marine Living Resources Conservation and Management; Morales, J., V. Stuart, T. Platt and S., Sathyendranath . Eds. EU PRESPO and IOCCG: Dartmouth, NS, Canada, Chapter 19: 273-293. [ Links ]
Santamaría-del-Ángel, E., I., Soto, J., Wolny, S., Cerdeira-Estrada, R., Cajal-Medrano, F., Muller-Karger, J., Cannizzaro, Y.X.S., Padilla-Rosas, A., Mercado-Santana, M.F., Gracia-Escobar, P., Alvarez-Torres and M.C., Ruiz-de-la-Torre. 2015. Phytoplankton Blooms : New Initiative Using Marine Optics as a basis for monitorin programs. Coastal Ecosystems: Experiences and Recommendations for Environmental Monitoring Programs: 57-88. Nova Science Publishers, Inc. [ Links ]
Sathyendranath, S., and A., More,. 1983. Light emerging from the sea interpretation and uses in remote sensing. Remote Sensing Applications in Marine Science and Technology, 323-357. https://doi.org/10.1007/978-94-009-7163-9_16 [ Links ]
Sathyendranath, S., G., Cota, V., Stuart, M., Maassandand Platt, T. 2001. Remote sensing of phytoplankton pigments: a comparison of empirical and theoretical approaches. Int. J. Remote Sens., 22: 249-273. https://doi.org/10.1080/014311601449925 [ Links ]
Thomas, C.S. 2012. The HPLC Method. Chapter 6. In: The Fifth SeaWiFS HPL Analysis Round-Robin Experiment (SeaHARRE-5). NASA/TM-2012-217503.SEAHERRE5, by: Stanford B.et al. November 2012:63-72. [ Links ]
Varela M., E., Fernandez and Serret, P. 2002. Size-fractionated phytoplankton biomass and primary production in the Gerlache and south Bransfield Straits (Antarctic Peninsula) in Austral summer 1995-1996. Deep-Sea Research II, 49: 749-768. https://doi.org/10.1016/S0967-0645(01)00122-9 [ Links ]
Vidussi, F., H., Claustre, B.B., Manca, A., Luchetta and J.C., Marty. 2001. Phytoplankton pigment distribution in relation to upper thermocline circulation in the eastern Mediterranean Sea during winter. Journal of Geophysical Research, 106(C9): 19939-19956. https://doi.org/10.1029/1999JC000308 [ Links ]
Wright, S.W., S.W., Jeffrey, R.F., Mantoura, C.A., Llewellyn, T., Bjornland, D., Repeta and N., Welschmeyer, 1991. Improved HPLC method for the analysis of chlorophylls and carotenoids from marine phytoplankton. Marine Ecology Progress Series, 77: 183-196. https://doi.org/10.3354/meps077183 [ Links ]
Wright, S. W., and S. W., Jeffrey. 2006. Pigment markers for phytoplankton production, in Marine Organic Matter: Biomarkers, Isotopes and DNA, edited by J. K. Volkmann, pp. 71-104, Spring, Berlin. https://doi.org/10.1007/698_2_003 [ Links ]
Wu, J., H., Hong, S., Shang, M., Dai, Lee, Z., J. Wu, H., Hong, S., Shang, M., Dai and Z.L.,Variation. 2007. Variation of phytoplankton absorption coefficients in the northern South China Sea during spring and autumn. Biogeosciences Discussions, 4(3):1555-1584. https://doi.org/10.5194/bgd-4-1555-2007 [ Links ]
Zhou, M., P.P., Niiler and J.H., Hu. 2002. Surface currents in the Bransfield and Gerlache Straits, Antarctica. Deep Sea Res. Part I: Ocean. Res. Pap. 49 (2):267-280. https://doi.org/10.1016/S0967-0637(01)00062-0 [ Links ]
Recibido: 30 de Julio de 2019; Aprobado: 16 de Octubre de 2019











 texto en
texto en 




