Introducción
El carcinoma escamocelular (CEC) es un cáncer originado en los queratinocitos de la epidermis1. Se ha clasificado dentro del grupo de carcinomas de piel no melanoma que integra: el carcinoma basocelular; el CEC y otros de menor incidencia como el dermatofibrosarcoma protuberans; el carcinoma de células de Merkel; el sarcoma de Kaposi; el queratoacan-toma; el tumor fusocelular; el carcinoma sebáceo, y tumores de anexos cutáneos, entre otros2.
EL CEC corresponde a un 20% de los anteriores, siendo el segundo en frecuencia después del carcinoma basocelular3-5. En Estados Unidos su incidencia ha tenido un incremento significativo en los últimos años2, con una incidencia de 356 por cada 100.000 en hombres blancos expuestos al sol6.
Karia et al. estimaron que en el 2012 se diagnosticaron entre 186.157 y 419.543 nuevos casos de CEC en la población blanca de Estados Unidos, de los cuales el 3% desarrollaron compromiso ganglionar y el 70% de estos últimos fallecieron a causa de CEC4.
En el Anuario estadístico 2012 del Instituto Nacional de Cancerología de Colombia (INC) el CEC correspondió al 16,1% de los casos de cáncer de piel7. Solo hace mención al CEC como diagnóstico general sin discriminarlo por su sitio anatómico. En la literatura mundial tampoco existe una publicación que permita evaluar la proporción de casos de CEC cutáneo (no anogenital) del tronco y las extremidades, quedando sugerido que el CEC del tronco y extremidades (sumando CEC cutáneo y CEC anogenital) puede corresponder a ese 25% del total de CEC, que resta al 75% que se localizan en las áreas fotoexpuestas de la cabeza y el cuello8. Lo anterior probablemente sea el resultado de la conducta mundial de no reportar en los sistemas de registro epidemiológico los carcinomas escamocelulares ni los basocelulares2.
La incidencia de CEC es significativamente mayor en hombres que en mujeres, con una razón de 2:19. La exposición excesiva y crónica a la radiación ultravioleta es el factor de riesgo más importante para desarrollar el CEC, lo que explica que las superficies cutáneas expuestas al sol sean las más proclives a estar afectadas por este cáncer. Existen otros factores de riesgo importantes como: el fototipo; el aumento en la prevalencia del virus del papiloma humano (VPH); la exposición a radiación ionizante; las cicatrices de quemaduras; las úlceras crónicas; los factores congénitos, y la inmunosupresión, bien sea por enfermedades como la leucemia, el linfoma, el VIH/SIDA o iatrogénicamente inducida en pacientes con enfermedad autoinmune o en receptores de trasplante de órganos, y en aquellos que han recibido terapia dirigida hacia mutaciones del RAF con medicamentos como el vemurafenib1-3.
Se denomina CEC in situ cuando está confinado a la epidermis, pero sus células pueden adquirir la capacidad de infiltrar la membrana basal y extenderse a la dermis y demás estructuras subyacentes, denominándose un CEC invasor. La gran mayoría de los casos corresponden a CEC invasores de bajo riesgo, con una baja tasa de metástasis que fluctúa entre2y5%3,5,9-11. No obstante existe un subgrupo denominado CEC de alto riesgo, con un comportamiento biológico más agresivo y una tasa de compromiso ganglionar de hasta 21%, exhibiendo mayor recurrencia locorregional y de metástasis a distancia12. Este grupo está determinado por características clínicas e histológicas que comprenden: el CEC recurrente; el estado de inmunosupresión del paciente; los CEC originados en úlceras crónicas, quemaduras, fístulas y cicatrices acuñados bajo el término de úlcera de Marjolin, diámetro de la lesión mayor a 2 cm, espesor tumoral mayor de 2 mm, pobre o ningún grado de diferenciación histológica, y la invasión perineural6,11,13-20. En los casos de compromiso nodal existe una supervivenciaa5añnos de 26% a 34%21,22.
Se ha descrito que algunos subtipos histológicos de CEC tienen un comportamiento más agresivo. Dentro de ellos cabe destacar el de patrón desmoplásico, con una mayor tasa de recurrencia6,20,23 y los subtipos adenoide, adenoescamoso, fusocelular y pseudoangiosarcomatoso, que exhiben características histológicas agresivas2,24. Sin embargo, estos subtipos histológicos no cuentan aún con resultados conclusivos para ser designados CEC invasor de alto riesgo20,25.
Estrategia de búsqueda
La búsqueda se realizó en la bases de datos de Pubmed y Lilacs con los términos MeSH y DeCS especificados. Se aceptaron artículos de revisión, reportes de caso, series de casos, ensayos clínicos y metaanálisis, así como la bibliografía secundaria derivada de los artículos hallados y publicados en inglés, español y portugués. Se excluyeron artículos que no tuvieran el texto completo disponible y no hubo restricción respecto a su año de publicación.
Manejo y estadificación del CEC
Las metástasis locales y regionales ocurren generalmente a través del sistema linfático vecino a la lesión en dirección hacia los ganglios linfáticos regionales22,26. Es por ello que la aproximación diagnóstica inicial en CEC de alto riesgo consiste en determinar el compromiso linfático regional para definir la necesidad de el vaciamiento ganglionar12. Esta evaluación se realiza a través del examen físico, siendo los grupos ganglionares axilares y epitrocleares los más frecuentemente afectados en tumores de los miembros superiores; los grupos inguinofemoral y poplíteo en tumores de los miembros inferiores; y los grupos axilar, inguinal y supra-clavicular en los casos en que el CEC afecta el tronco2.
Dependiendo de la presencia o la ausencia de adenopatías locales y teniendo en consideración los grupos de riesgo se determina el abordaje terapéutico (fig. 1) de la siguiente manera:
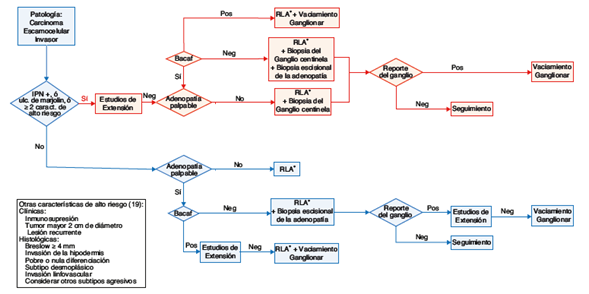
Figura 1 Flujograma de la estadificación y manejo quirúrgico del paciente con CEC no anogenital del tronco y extremidades. IPN + : Presencia de Invasión PeriNeural. Ulc. de Marjolin: Origen en úlcera de Marjolin. RLA: Resección local amplia. BACAF: Biopsia por Aspiración con Aguja Fina. Pos: Reporte de compromiso tumoral. Neg: Ausencia de compromiso tumoral. *Se deben asegurar márgenes quirúrgicos negativos, si son reportados comprometidos por tumor, se recomienda su ampliación.
Manejo pacientes con CEC de bajo riesgo
El tratamiento inicial en pacientes con CEC de bajo riesgo sin adenopatía palpable es la resección local amplia con márgenes quirúrgicos adecuados27. Esta conducta se basa en recomendaciones establecidas por estudios observacionales que tienen en cuenta el tamaño, la localización y las características histológicas del tumor. Para la mayoría de CEC de bajo riesgo se recomiendan márgenes quirúrgicos de 4-6 mm24,28-30.
La conducta en pacientes con CEC de bajo riesgo con adenopatía palpable es la escisión del tumor con margen quirúrgico de 4-6 mm24,29 y el estudio del ganglio mediante aspiración con aguja fina (ACAF). Si el informe citológico es negativo se encuentra indicado realizar biopsia escisional de la adenopatía, con el fin de hacer el diagnóstico diferencial entre un verdadero negativo (adenopatía de etiología inflamatoria/infecciosa) y un falso negativo31. Si el ACAF es positivo el paciente debe ser estudiado con imágenes para caracterizar el compromiso ganglionar y será definido como candidato a un vaciamiento ganglionar del nivel afectado y de un nivel superior cuando sea factible31.
Manejo pacientes con CEC de alto riesgo
En pacientes con CEC de alto riesgo sin adenopatía palpable está indicada la resección local con márgenes laterales y profundos mayores de 6 mm cuando sea clínica y quirúrgicamente viable20,24. En ausencia de una conducta sedimentada en la literatura, considerando la naturaleza agresiva de estas lesiones y su extensión subclínica20, en el INC se realiza biopsia del ganglio centinela y resección del tumor primario con un margen quirúrgico de 2 cm y cuando es necesario se realiza una amputación o desarticulación.
En pacientes con CEC de alto riesgo con adenopatía palpable se debe realizar ACAF de la adenopatía. Si esta es positiva el paciente debe ir a resección local amplia con margen quirúrgico de 2 cm y vaciamiento ganglionar, de lo contrario se realiza la resección y biopsia del ganglio centinela 31. En algunos pacientes con carcinoma escamocelular de gran tamaño con compromiso óseo o neurovascular, la resección quirúrgica incluye amputaciones menores y mayores con el objetivo de lograr márgenes quirúrgicos sin compromiso tumoral.
El vaciamiento ganglionar es la técnica más sensible para la estadificación ganglionar, pero se evita su uso como método diagnóstico de rutina por la morbilidad propia de un procedimiento invasivo con complicaciones como el linfedema de la extremidad y la susceptibilidad a infecciones de tejidos blandos, lesiones neurológicas y vasculares. Se han descrito técnicas de estadificación ganglionar mediante evaluación ecográfica asociada a ACAF ecoguiada con una precisión del 93% en CEC de cabeza, cuello y genital32,33. Bajo la necesidad de considerar un método de diagnóstico menos invasivo y por ende menos mórbido, ha surgido la biopsia de ganglio centinela como un estrategia alterna para la identificación de micro o macrometástasis ganglionar en cadenas ganglionares negativas a la palpación.
Utilidad del ganglio centinela en el CEC
El ganglio centinela es el primer ganglio de una cadena linfática en recibir el drenaje de un territorio tisular. Su técnica se encuentra descrita y bien definida desde la década de los años 80 y para su marcación se usa azul de isosulfán o azul de metileno o un nanocoloide marcado con Tecnecio 9934.
La biopsia de ganglio centinela tiene una utilidad establecida en la estadificación del cáncer de mama y del melanoma, siendo ampliamente aceptado como una técnica mínimamente invasiva y de alta precisión para detectar metástasis ganglionares subclínicas35-42.
La utilidad clínica del ganglio centinela en melanoma ha motivado su aplicación en otras malignidades cutáneas en las que el riesgo de compromiso nodal supera el umbral del 10%. Numerosos estudios han evaluado la utilidad del ganglio centinela en cáncer escamocelular de cabeza, cuello y en territorio vulvar con resultados que sugieren su utilidad en CEC de alto riesgo14,22,26,43-46. La mayoría de las metástasis del CEC migran inicialmente a un ganglio linfático y posteriormente se diseminan a otros ganglios, los pulmones, el hígado, el cerebro, la piel o los huesos, lo que hace suponer que la detección temprana de micrometástasis en el ganglio centinela, con el posterior vaciamiento ganglionar que ese hallazgo deriva, podría impactar favorablemente en la supervivencia libre de enfermedad y la supervivencia global de los pacientes8, sin embargo estos aspectos deben ser evaluados en estudios prospectivos sobre la utilidad del ganglio centinela en CEC.
El estudio del ganglio centinela ha ganado espacio en el CEC de cabeza y cuello y en el CEC anogenital; al ser comparada con imágenes y con el vaciamiento ganglionar la palpación de las cadenas ganglionares reporta falsos negativos del 15 a 39% en la detección de metástasis ganglionares en CEC32 , 33 , 47. La técnica del ganglio centinela ha sido validada en pacientes con CEC oral y se encuentran en proceso de estudio a gran escala para evaluar su precisión diagnóstica en este grupo de pacientes.
La tasa de detección del ganglio centinela se puede ver disminuida cuando existe antecedente de disrupción de la continuidad de la vía linfática, como en los casos de cirugía o radioterapia previa en el trayecto entre la lesión y la cadena ganglionar más cercana12. En CEC de cabeza y cuello, donde existe un drenaje linfático complejo, la tasa de detección ha sido descrita del 95%48, y del 96% en los CEC cutáneos no anogenitales, la cual es optimizada cuando es realizada con técnica dual usando inyección de radiocoloide y tinción con azul12.
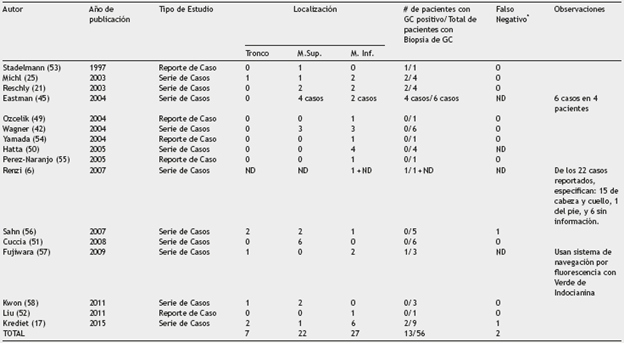
A diferencia de los pacientes con CEC de cabeza-cuello y CEC anogenital, en pacientes con CEC de tronco y extremidades no hay evidencia científica de alta calidad que permita establecer la utilidad del ganglio centinela para el CEC de alto riesgo. La evidencia se encuentra limitada a pequeñas series de casos en las que se expone el uso de esta técnica como extrapolación del procedimiento en CEC de cabeza y cuello49-52 . En la tabla 1 se extraen los pacientes con CEC no anogenital del tronco y extremidades de los reportes y series de casos disponibles en la literatura, a quienes se les realizó biopsia de ganglio centinela9,18,22,26,43,46,49-58. La experiencia de casos clínicos sugiere que la biopsia de ganglio centinela en esas localizaciones permite identificar de forma precisa el compromiso metastásico ganglionar y además de ser un procedimiento bien tolerado por los pacientes. Sin embargo, es necesaria la realización de ensayos clínicos al respecto para definir el beneficio en la supervivencia y establecer una indicación precisa8.
Tasa de positividad en cadenas No palpables (cN0)
Con el sistema alternativo de la clasificación de la AJCC-7 propuesta por Schmitt et al. se obtienen tasas de positividad del 29% del ganglio centinela cuando es realizado en los pacientes con más de dos factores de riesgo, en contraste con aquellos con un solo factor de riesgo en quienes la tasa de positividad es del 7%8. Los factores de riesgo tenidos en cuenta por Schmitt et al. son el tamaño tumoral mayor de 2 cm, pobre o nula diferenciación histológica, invasión perineural e invasión tumoral sobrepasando la hipodermis. No incluyeron el Breslow porque la mayoría de las biopsias eran por afeitado, lo que limitó el estudio del espesor tumoral como factor de riesgo59. Sin embargo, el Breslow debe seguir siendo considerado un factor de riesgo de metástasis60, como fue demostrado en el estudio de Veness donde el 30% de los 266 pacientes con CEC de cabeza y cuello desarrollaron enfermedad metastásica a la cadena ganglionar a pesar de tener un diámetro tumoral menor de 2 cm, pero con un espesor tumoral importante60. Aquellos CEC con 4 factores de riesgo o con compromiso óseo (T3 del AJCC) tienen una tasa de positividad del 50% en la biopsia del ganglio centinela8,30.
Falsos negativos al compararse con linfadenectomía y/o seguimiento
En series de pacientes con CEC con 12 y 9 ganglios centinelas negativos se han reportado tasas de falsos negativos de 8% y 11% respectivamente, correspondientes a dos tumores localizados en cuero cabelludo y en el pulgar: el primero corroborado en la linfadenectomía cervical y el segundo por presentar metástasis a distancia y muerte en un periodo de 9 meses. Dentro de las posibles causas se encuentran: la baja experiencia en la realización del procedimiento; la alteración del drenaje linfático por una resección/reconstrucción previa; las vías alternas no identificadas de diseminación linfática; los criterios no unificados para la selección de los pacientes43,56, sin olvidar aquellos debidos a una falla en los cortes seriados, tinción inmunohistoquímica y lectura histopatológica del ganglio, descritos en CEC anogenital12,61.
En la revisión sistemática de Ross y Schmults12, de los 85 pacientes con CEC cutáneo que incluyó pacientes con CEC cutáneo de cabeza y cuello, a 20 pacientes se les realizó linfadenectomía independientemente del reporte negativo del ganglio centinela y se identificó un paciente con compromiso ganglionar (sensibilidad 95%) correspondiente al falso negativo descrito previamente por Wagner43.
Complicaciones
La biopsia de ganglio centinela en CEC presenta una baja tasa de complicaciones que suelen ser leves con un manejo adecuado, entre ellas: hematoma, seroma, fístula linfática, infección y dehiscencia de la herida12. Se hace énfasis que los estudios requieren un seguimiento mayora5anños para establecer las verdaderas tasas de recurrencia y metástasis en los pacientes con CEC de alto riesgo con ganglio centinela reportado negativo8.
Conclusión
Desde hace 10 años en el INC se realiza biopsia de ganglio centinela a los pacientes con CEC de alto riesgo no anogenital del tronco y extremidades, siguiendo el algoritmo de la figura 1, lo que ha permitido recolectar la experiencia con 60 pacientes que constituye la serie de casos más extensa en este tema. Los resultados preliminares muestran compromiso tumoral del ganglio centinela en el 15% de los casos y eso se asocia a factores de mal pronóstico como: el Bres-low mayor de 4 mm, la invasión linfovascular o perineural, el origen en úlceras crónicas y la inmunosupresión62. Se resalta la necesidad de estudios prospectivos y controlados en este campo.
Es así que con el objetivo de definir la presencia de metástasis ganglionares se documenta la plausibilidad de realizar la biopsia del ganglio centinela en casos de CEC de alto riesgo no anogenital del tronco y extremidades sin compromiso metastásico a distancia que no tienen adenopatía palpable y en aquellos que debutan con adenopatía palpable cuyo ACAF haya sido reportado negativo12,31.