Introducción
El melanoma lentiginoso acral (MLA) fue reportado por primera vez en 1976 por Clark, y fue descrito por Reed y colaboradores, en 1977, como un subtipo de melanoma con predilección por zonas distales tales como palmas, plantas, falanges terminales y la unidad ungular 1,2.
El MLA, es la variante más frecuente de melanoma en poblaciones asiáticas, afrodescendientes y latinoamericanas (3, 4); a diferencia de las poblaciones blancas donde solo del 5 al 10% del total de casos diagnosticados corresponden a esta variante 5,6. Esta infrecuencia explicaría la escasa información de MLA que se encuentra en la literatura, en comparación con otras variantes como el melanoma de extensión superficial.
Aunque los factores de riesgo para desarrollar MLA no están bien esclarecidos, se han asociado a factores como la edad, el sexo, el número de embarazos y el tabaquismo 7-10, así como factores genéticos 11,12. Se ha sugerido una asociación con trauma, la cual, a pesar de no ser estadísticamente significativa, se continúa reportando 13-15.
Al igual que en los otros subtipos de melanoma, el diagnóstico es clínico e histopatológico, y los factores de mal pronóstico son el grosor, mediante la medición de Breslow, y la presencia de ulceración 16. Se ha sugerido que el MLA tiene un peor pronóstico comparado con otras variantes de MM; posiblemente, esto está asociado al diagnóstico tardío 17. La presente revisión pretende hacer una actualización de la epidemiología, los factores de riesgo, las características genéticas y el tratamiento del melanoma lentiginoso acral en el contexto de Latinoamérica y el mundo.
Epidemiología
La incidencia de MM en el mundo se ha incrementado durante las últimas décadas 18-20 ; sin embargo, ésta varía según el grupo étnico y la localización geográfica, con predilección en países con población predominantemente de piel clara. La incidencia reportada para melanoma en Australia es de 72/100.000 habitantes, siendo ésta la más alta del mundo 21. En Estados Unidos se reporta una incidencia de 19,7/100.000 habitantes según la base de datos -"SEER"- del Instituto Nacional de Cáncer 6,19,22. Otras poblaciones, como la europea, reportan incidencias de 9,9-29.6/100.000 casos por año 22,23. El MM es menos frecuente en poblaciones no caucásicas como las de Sur América, América Central, el Pacífico, África y Asia, donde se reportan incidencias de menos de 4/100.000 por año 22,23.
En cuanto a las variantes de MM, se ha establecido que en población blanca, de los 4 subtipos existentes, el más frecuente es el melanoma de extensión superficial (60-70%), seguido del melanoma nodular (15-30%), el léntigo maligno melanoma (5%) y el lentiginoso acral (5-10%) 24. Este último presenta un comportamiento epidemiológico distinto a los otros: es el menos frecuente en personas blancas caucásicas y el más frecuente en etnias de color, como lo son africanos, asiáticos e hispanos 3. En las series reportadas en Latinoamérica, el melanoma lentiginoso acral representa el 44.1% de los casos de melanoma cutáneo en México 17, 61.2% de los casos en Perú 25, 18.6% de los casos en Chile, 7.1% de los casos en Brasil 26 y 6% de los casos en Argentina 27.
Para Colombia, los datos con respecto a MM son heterogéneos. Según el registro poblacional de Cali, la incidencia de MM por 100.000 habitantes es de 2,7 y 2,5 para hombres y mujeres respectivamente 28. La incidencia reportada para Bucaramanga es de 1,7 por cada 100.000 habitantes; la localización anatómica más afectada fue miembros inferiores (42,6%) con una proporción importante de compromiso en palmas, plantas (16%) y región subungueal (7,1%) 29. Los primeros datos del Centro Dermatológico Federico Lleras Acosta (CDFLLA) reportaron un aumento en la frecuencia de pacientes diagnosticados con MM de 2,7/10.000 en el 2003 a 13/10.000 en el 2005 30. Datos más recientes, correspondientes a los años 20122016, en un estudio conjunto del CDFLLA y la Clínica Colombia en Bogotá, reportan un aumento de más del doble, pasando de 22 casos nuevos en 2012 a 64 casos nuevos al año 2016. En este mismo estudio se reporta que el subtipo de melanoma más frecuente en ambas instituciones fue el léntigo maligno (51%), seguido por el MLA (24%) 31. En un estudio del Instituto Nacional de Cancerología (INC), correspondiente a los años 2006 a 2010, la localización más frecuente correspondió a la acral (43.7%), seguida de cabeza y cuello (24%) 32. Estos datos son similares a lo reportado por la Universidad de Caldas, donde el MLA fue el más frecuente (24%), seguido del melanoma de extensión superficial (23%) 33. Finalmente, otro estudio realizado en Bogotá, esta vez en un centro de referencia oncológico privado donde se atiende población predominante de estratos altos, se reportó que de los 415 pacientes examinados entre los años 1999 y 2014, el melanoma más frecuente fue el melanoma de extensión superficial (42,7%), seguido del léntigo maligno melanoma (33,7%) y el MLA (18,3%) 34. Estas diferencias podrían darse por la disparidad de etnias y fototipos de los pacientes vistos en estas instituciones, lo que se relaciona con la gran mezcla racial y genética que hay no sólo en Bogotá, sino en Colombia.
Factores de riesgo
El MLA no parece asociarse con los factores de riesgo originalmente descritos para MM, como son la historia de nevus atípicos (sólo se ha asociado menos del 10% con este antecedente), la historia familiar de melanoma o la exposición solar crónica 8,35. En el contexto del MLA se han dilucidado factores diferentes tales como: factores biológicos (raza, edad, sexo, número de embarazos), genéticos, tabaquismo e historia de trauma en la zona de aparición del tumor 7,9,10,12,15,36.
Factores biológicos
Respecto a la raza, el MLA es el subtipo de melanoma más frecuente en población no caucásica; en mayor porcentaje están las personas de raza negra (70%), seguidas de la población asiática (40%); en tercer lugar están los hispanos (15 %) y en último lugar de incidencia los caucásicos (2 a 8%) 3,4.
En la literatura se describen casos de MLA a partir de los 50 años, con un aumento exponencial a partir de la sexta década de la vida, y con un pico máximo a los 70 años. Se considera que el MLA, últimamente, se diagnostica a una edad más temprana gracias a las campañas de detección oportuna que se realizan 37. Respecto al sexo, los resultados han sido diversos; algunos estudios no reportan una relación y otros hablan de una relación 1.8:1, con mayor prevalencia en las mujeres 8,38, especialmente en mujeres que tuvieron uno o más embarazos en el caso de MLA plantar (OR 4.9 CI 0.6 - 40.9) 39. En un estudio realizado en el Instituto Nacional de Cancerología con 90 pacientes, se reporta mayor frecuencia en hombres que en mujeres (61.11% vs 38.89%) 40.
Factores genéticos
Las características genéticas del melanoma han sido descritas de acuerdo con el subtipo 41. Los melanomas en piel con exposición solar presentan principalmente mutaciones en los genes que codifican las proteínas de la cascada de señalización MAPK (proteínas quinasas activadas por mitógenos). Estos incluyen mutaciones en BRAF, RAS, KIT, ERK, MEK y EGFR 12,42,43. En una revisión sistemática de Gutiérrez y colaboradores, publicada en 2020, se reportó una frecuencia de mutaciones en BRAF, NRAS y KIT en melanoma del 38%, 16% y 10% respectivamente, para melanomas de extensión superficial 44.
Se han descrito numerosos factores genéticos para el desarrollo de melanoma acral. Un estudio -donde se evaluó una cohorte de pacientes con MLA usando secuenciación dirigida o técnicas de nueva generación para la secuencia del genoma- encontró una baja frecuencia de variantes de nucleótido sencillo (SNP) y una alta frecuencia de alteraciones estructurales grandes (rearreglos cromosómicos) 45,46. Las mutaciones conductoras se encuentran en genes de la vía BRAF/RAS; sin embargo, presentan menor frecuencia que para el resto de los melanomas. En diferentes poblaciones se ha encontrado para BRAF 14,8°% y para NRAS 13,3°% y KIT en el 11°% 12,43,47. Otros genes relacionados con MLA son el gen que codifica para la Ciclina D1 (CCND1), para la quinasa 4 dependiente de clínica (CDK4), para la proteína de unión 2 asociada a GRB2 GAB2 y para la telomerasa TERT 48-50. Variantes en el promotor de TERT han sido encontradas en 9,3% en MLA 51.
En una muestra de pacientes colombianos con melanoma, se encontró que en el grupo de pacientes con MLA la frecuencia de mutaciones BRAF y NRAS fue mayor a lo reportado (61 y 77%). Ninguno de los MLA presentó mutación en KIT 52. Yeh y colaboradores realizaron el perfilamiento genético de 122 melanomas acrales en población norteamericana, encontrando las clásicas mutaciones en BRAF (21,3%), NRAS (27,9%) y KIT (11,5%); en conjunto con otras alteraciones activadoras de la vía MAPK, como fusiones de BRAF (2,5%), NTRK3 (2,5%), ALK (0,8%) y PRKCA (0,8%); inactivación de NF1 (14%), inactivación de SPRED1 (6,6%), entre otras alteraciones como amplificaciones en regiones que contenían genes como PAK1, GAB2, CDK4, ,CCND1, EP300, YAP1, MDM2 y TERT. Este trabajo hizo distinción entre dos subtipos de MLA: el portador de la mutación BRAF V600E y el no portador de V600E, cuyo perfil genético es más complejo al poseer otros tipos de alteraciones 12.
Antecedente de tabaquismo
Algunos estudios han descrito al tabaquismo como factor protector para melanoma cutáneo (53, 54). Sondermeijer y colaboradores reportaron un estudio de casos y controles con 1.517 pacientes y 5.595 controles, evidenciando una relación inversa entre la presencia de MM y el número de años de tabaquismo de los casos. A los 40 años reportaron un OR = 0.26 (IC 95%: 0.15-0.44), mientras que a los 20 años de consumo de tabaco el OR = 0.61 (IC 95%: 0.46-0.80), siendo estadísticamente más significativo en los hombres que en las mujeres 53. Gibson y colaboradores encontraron que los fumadores tenían un 30% menos de probabilidades de desarrollar melanoma que los no fumadores, con un OR=0.70 (IC 95%: 0.65-0.76).
Sin embargo, los fumadores tenían un 30% más de riesgo general de muerte en comparación con los no fumadores, con un HR=130 (IC 95%:109-155), pero no hubo un efecto significativo sobre la supervivencia específica del melanoma 54. Si bien algunos estudios recientes también encontraron que el tabaquismo no influyó en la supervivencia específica del melanoma 55, otros han informado una peor supervivencia específica del melanoma en fumadores 56.
Antecedente de trauma
En 1880, Busch introdujo el trauma como una posible causa de MLA 36, y desde allí hasta la actualidad, el debate con esta asociación se mantiene vigente. Cabe resaltar que éste se encuentra sujeto a la memoria del paciente y al sitio exacto del trauma seguido del MLA. Los estudios que se han desarrollado alrededor de esta temática han marcado ciertos lineamientos, tales como: irritación constante, antecedentes de quemadura, tatuajes, punciones, golpes con o sin distrofia ungular, fractura del hallux, trauma penetrante (RR = 5.0 CI 3.0-8.6), cortaduras y uso de botas 9,14,15.
En 1935 se publicó un artículo en el que se proponían los siguientes criterios para establecer una relación de trauma con cáncer: auténtica y adecuada historia de trauma, lugar de aparición del tumor en piel previamente sana, origen del tumor en el lugar exacto del trauma, aparición de MLA posterior al trauma en un tiempo considerable y confirmación del hallazgo del tumor 57. Estos criterios permitieron la asociación de casi cualquier patología cutánea con el trauma; de esta manera se reportaron casos de melanoma (no solo acral), sino también de carcinoma basocelular (CBC) y carcinoma escamocelular asociados a trauma . Hacia los años sesenta se habían publicado muchos reportes de casos en los que se mencionaban antecedentes de trauma (meses o años atrás) en pacientes con MLA. Pero sólo Lea, en el año 1965, menciona la importancia de tener un grupo comparador para poder validar la asociación que hasta ese momento se daba por hecho. Este investigador tomó datos de 503 pacientes con CBC y 193 con MM de dos centros hospitalarios, encontrando que el 11% y el 20% de estos pacientes referían un trauma previo en el sitio del tumor 36. A pesar de estos hallazgos, no hay estudios posteriores que relacionen el CBC con el trauma, y es que con los números hay que tener precaución ya que los resultados de estudios sesgados pueden arrojar resultados que no son verdaderos.
La relación MM y trauma siguió sugiriéndose por su localización acral y por presentarse en poblaciones que realizaban mayores actividades manuales 59. En el caso de MLA subungeal, se describió una relación directa entre el área de extensión de la uña y el riesgo de trauma; así mismo, el 90% de los MLA subungeales se ubican en los pulgares y los hallux, pero también es importante resaltar que el trauma ungueal es mucho más común en contraste con sólo el 29% de aparición de MLA subungeal 60; esta teoría sigue el lineamiento que afirma que en la vida cotidiana se traumatizan con mayor frecuencia las manos que los pies, pero el MLA en miembros superiores es significativamente menor (1.9%) que el presentado en los miembros inferiores (11.4%) 37,59.
En 1997 se publica el primer estudio que compara casos de melanoma con controles 39. Este estudio se llevó a cabo en Paraguay, donde los autores mencionan que la población es descendiente de indígenas guaraníes y de españoles, y a diferencia de otras áreas de Latinoamérica, no tienen ancestro negro africano. Así mismo, describen los autores que gran parte de la población vivía en zona rural, trabajaba en el campo y andaba descalza. Ellos recolectan 60 casos de melanoma acral y 256 controles. Los autores reportan que los principales factores de riesgo para desarrollar MLA fueron: una historia de trauma continuo con un OR de 2,5 (IC95% 1.4-4.5) y nevus en las plantas, con un OR de 2.7 (1.5-4.8).
Dos años después, en 1999, se publica otro estudio de casos y controles, esta vez tomando población de Australia y Escocia 61. En total 275 casos y 496 controles. En este estudio, el trauma penetrante en manos o pies generó un OR de 5 (3.0-8.6). Uno de los inconvenientes de este estudio es que el trauma, al igual que otras variables, sólo pudo evaluarse en los casos australianos, y la información fue autodiligenciada por el paciente o por un familiar, en el caso de que el paciente hubiera muerto. En ese sentido, los autores reconocen que no se pudo establecer si el trauma había ocurrido en el sitio donde apareció el melanoma o en otras áreas de las plantas o las palmas.
En el 2000 se publica una gran serie de 369 pacientes con melanoma cutáneo en sus diferentes variantes clínicas 15: el 99% de los casos negó un antecedente de trauma, 22 pacientes reportaron un evento traumático único y 10 irritación persistente. Cuando se comparó el antecedente de trauma entre pacientes con MLA y otros melanomas, no se encontraron diferencias estadísticamente significativas. Un resultado contrario encontraron Phan y colaboradores en Francia 35, cuando compararon 126 casos de MLA con 1850 melanomas de otros subtipos; ellos encontraron diferencias significativas (p<0,01) con respecto al antecedente del trauma. Una debilidad de este estudio es que sólo en 42 pacientes encontraron registro de trauma en las historias clínicas.
A diferencia de lo esperado, en los últimos años hay pocas publicaciones. En 2013 se publica un estudio con población Coreana 14; los autores tomaron en total registros de 177 MLA, de estos sólo 52 (29%) tenían información acerca del antecedente de trauma; en 15 de ellos se registró un recuerdo de trauma. Estos autores, al igual que otros previamente 62,63, mencionan que el melanoma es más frecuente en áreas de las plantas de los pies que soportan más peso (es decir, son infrecuentes en los arcos plantares). En 2016 64, se reporta un estudio con población china, en donde de 56 melanomas acrales, 12 referían historia de trauma (21%). En el año 2016, se publica un estudio de Japón 65 con 123 melanomas en las plantas; de estos, 50 se localizaban en la parte posterior del pie, 32 en la parte delantera, 14 en el mediopie y 3 en el arco; los autores sugieren que el MLA se ubica en estos sitios probablemente por un estrés mecánico y continuo.
En 2017 se publican los datos de 122 pacientes con MLA de la Clínica Mayo en EEUU. El 85% de los pacientes eran blancos, excluyendo los pacientes obesos; la localización del melanoma tendió a localizarse en las regiones que soportan peso 66.
En este orden de ideas, hay numerosos reportes que sugieren asociación entre MLA y trauma. Dicha asociación está soportada por dos estudios de casos y controles, y algunos estudios observacionales; a pesar de esto, el sesgo de memoria, la falta de un grupo control y la falta de registros completos podrían confundir la verdadera relación entre el tumor y el antecedente de trauma. Pero no se debe menospreciar la casuística que se ha reportado en la literatura desde hace varios años, y se podría concluir que podría existir una relación entre el trauma y el desarrollo de algunos melanomas acrales. Sin embargo, aún quedan numerosas preguntas por resolver: ¿qué porcentaje de los melanomas acrales se origina por trauma?, ¿si es real esta asociación, cuanto tiempo tendría que pasar para que se desarrollara el tumor?, ¿el trauma se desarrolló en el mismo sitio del tumor?, ¿qué tipo de trauma se asocia con MM?, ¿el trauma fue un antecedente anecdótico que le permitió al paciente reconocer el tumor?, ¿es el trauma agudo o el trauma crónico, el que está asociado con MLA? Para resolver estas inquietudes, el camino es el desarrollo de trabajos de investigación prospectivos de alta calidad.
Cuadro clínico y diagnóstico
El MLA se presenta en forma clásica como máculas o parches irregularmente pigmentados, con tonos de color entre pardo y negro (Figura 1).
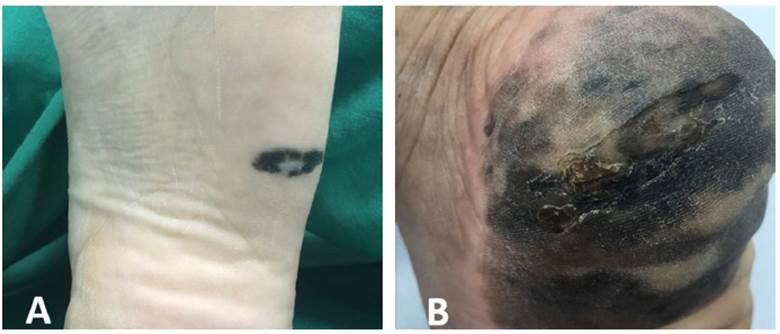
Figura 1 Presentación clínica del melanoma acral lentiginoso en región plantar.A) Mácula negruzca, asimétrica, de bordes irregulares, bien definidos, con áreas de hipopigmetación central. B) Extensa mácula heterogénea en colores (negro, pardo claro, pardo oscuro, grisáceo), de bordes irregulares, mal definidos, con área de ulceración central.
Las zonas de aparición comprenden regiones El MLA de aparición en zonas no subungueales se corporales distales, tales como palmas, plantas, caracteriza por iniciar como una mácula atípicamente falanges terminales y la unidad ungueal; no obstante, pigmentada, con bordes irregulares de crecimiento se suele subdividir clínicamente en MLA palmoplantar progresivo; con el avance en el crecimiento vertical, (no subungueal) y subungueal 1,2,67.
El MLA de aparición en zonas no subungueales se caracteriza por iniciar como una mácula atípicamente pigmentada, con bordes irregulares de crecimiento la lesión comienza a elevarse generando pápulas o placas sobre la mácula inicial, en algunos casos ulcerándose (Figura 2).
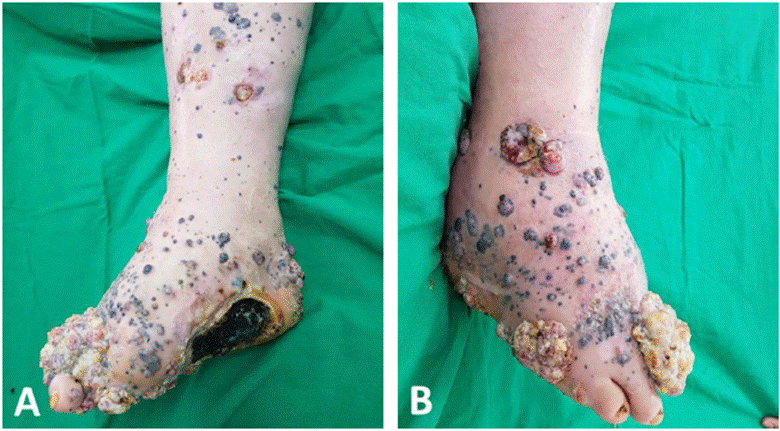
Figura 2 Melanoma acral lentiginoso con metástasis en tránsito. En A y B se observa ausencia de primer artejo asociado a extensa placa de aspecto tumoral, comprometiendo aspecto dorsal y plantar del pie derecho, con múltiples lesiones nodulares satélites pigmentadas.
En el caso del MLA subungueal, este se manifiesta como una banda pigmentada longitudinal que crece desde la lúnula hacia distal con bordes irregulares en el lecho o la placa ungueal, generalmente en un único dedo. Para sospechar el diagnóstico es de utilidad el signo de Hutchinson (pigmentación que sobrepasa los pliegues ungueales) (Figura 3). Adicionalmente, el cuadro podría acompañarse de distrofia o destrucción ungueal 9,68,69.
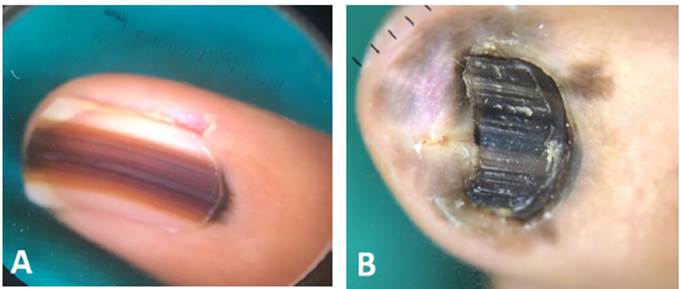
Figura 3 Hallazgos dermatoscópicos en Melanoma Acral Lentiginoso de la unidad ungueal. A) bandas irregulares pardo oscuro y claro, de diferentes grosores sobre un fondo marrón claro, con un ancho de la pigmentación mayor a 3 mm, y pigmentación del pliegue ungueal proximal (signo de Hutchinson). B) Melanoniquia completa de diferentes tonos de pardo y negro, signo de Hutchinson en pliegues ungulares proximal, distal y laterales, asociado a distrofia ungueal.
El diagnóstico de MLA es un reto, por lo cual la sospecha clínica debe ser confirmada con un reporte histopatológico . Resulta de gran importancia una caracterización clínica juiciosa de las lesiones, dado que éstas suelen confundirse con otras condiciones como micosis, lesiones traumáticas, nevus acrales, infecciones, queratoacantomas e incluso tilosis en casos de melanomas amelanóticos 68-70 (Figura 4).
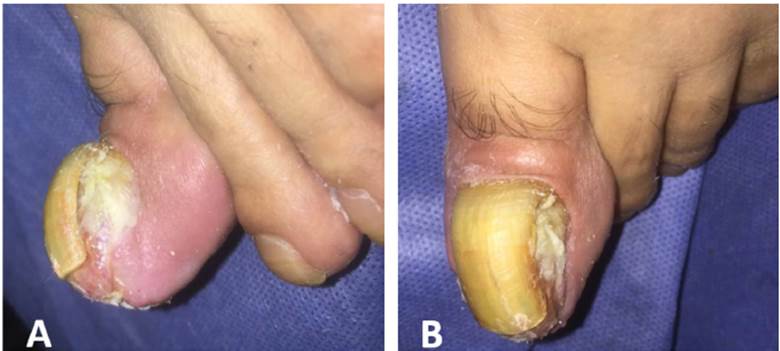
Figura 4 Melanoma Amelanótico. Nódulo tumoral exofítico sobre lecho ungueal en primer artejo de pie izquierdo, el cual desplaza la lámina ungueal y genera distrofia y deformidad a este nivel.
Se ha descrito que es de gran utilidad para el tamizaje de melanoma el ABCDE de las lesiones pigmentadas (Asimetría, Bordes, Color, Diámetro, Evolución); sin embargo, en lesiones de corta evolución es difícil hacer una distinción clara entre MLA y otras lesiones pigmentadas .
En el contexto de las lesiones pigmentadas, la dermatoscopia se ha convertido en una ayuda diagnóstica indispensable para los dermatólogos; en el caso del MLA, es de gran utilidad, siendo el hallazgo de mayor precisión el patrón paralelo de la cresta con una especificidad del 99% (pigmento que sigue las crestas de los dermatoglifos) con otros hallazgos menos específicos como los glóbulos de pigmento y el velo azul en los casos de MLA no subungueal . En melanoma subungueal son útiles la identificación del signo de micro-Hutchinson en pliegues ungueales y la forma triangular de la banda pigmentada, con su base orientada hacia el pliegue proximal .
Histología
El MLA es muy similar al resto de subtipos de MM desde el punto de vista histopatológico. En estadios tempranos, el diagnóstico es complejo dada la presencia de melanocitos solitarios en epidermis sin atipia o pleomorfismo; sin embargo, en fase de crecimiento radial se pueden observar melanocitos atípicos conformando nidos desorganizados o mal circunscritos orientados de forma paralela sobre la epidermis (crecimiento lentiginoso) y en algunos casos rodeando sus anexos . Las células tumorales se localizan generalmente sobre la unión dermoepidérmica o en capas superficiales de la epidermis 68. En fases avanzadas como la vertical, los nidos se disponen en nódulos y ya se puede evidenciar compromiso vascular o linfático . En el contexto de un diagnóstico difícil, existe la posibilidad de realizar marcadores de inmunohistoquímica útiles, como HMB-45, S-100, enolasa neuronal específica, entre otros. Para establecer la expresión molecular del tumor, también es posible llevar a cabo estudios como PCR (reacción en cadena polimerasa) .
Estadificación
Para MLA se utiliza el sistema de estadificación de la AJCC octava edición, en el cual se tienen en cuenta los determinantes clínico-patológicos TNM (ver tablas 1,2,3,4) .
Tabla 1 CRITERIOS T
| CRITERIOS (T) | ||
|---|---|---|
| CATEGORÍA T | GROSOR | ULCERACIÓN |
| TX: Tumor primario, grosor no evaluado | No aplica | No aplica |
| T0: Sin evidencia de tumor primario | No aplica | No aplica |
| Tis: Melanoma in situ | No aplica | No aplica |
| T1 | <1.0 mm | Desconocido o no especificado |
| T1a | <0.8 mm | Sin ulceración |
| T1b | <0.8 mm | Con ulceración |
| 0.8-1.0 mm | Con o sin ulceración | |
| T2 | >1.0-2.0 mm | Desconocido o no especificado |
| T2a | >1.0-2.0 mm | Sin ulceración |
| T2b | >1.0-2.0 mm | Con ulceración |
| T3 | >2.0-4.0 mm | Desconocido o no especificado |
| T3a | >2.0-4.0 mm | Sin ulceración |
| T3b | >2.0-4.0 mm | Con ulceración |
| T4 | >4.0 mm | Desconocido o no especificado |
| T4a | >4.0 mm | Sin ulceración |
| T4b | >4.0 mm | Con ulceración |
Adaptado de: Gershenwald JE, Scolyer RA, Hess KR, et al. Melanoma staging: Evidence-based changes in the American Joint Committee on Cancer eighth edition cancer staging manual. CA Cancer J Clin. 2017;67(6):472-492. doi:10.3322/caac.21409
Tabla 2 CRITERIOS N
| CRITERIOS (N) | ||
|---|---|---|
| CATEGORÍA N | # DE NODOS LINFÁTICOS REGIONALES INVOLUCRADOS | PRESENCIA DE METÁSTASIS EN TRÁNSITO, SATÉLITES Y/O MICROSATÉLITES |
| NX | Nodos regionales no evaluados | No |
| N0 | No metástasis regional detectada | No |
| N1 | 1 nodo afectado o cualquier número de metástasis en tránsito, satélite y/o microsatélite sin ganglio involucrado. | |
| N1a | 1 nodo clínicamente oculto | No |
| N1b | 1 nodo clínicamente detectado | No |
| N1c | Sin nodo regional afectado | Si |
| N2 | 2 o 3 nodos afectados o cualquier número de metástasis en tránsito, satélites y/o microsatélites con 1 nodo involucrado. | |
| N2a | 2 o 3 nodos clínicamente oculto | No |
| N2b | 2 o 3 nodos clínicamente detectados | No |
| N2c | 1 nodo clínicamente oculto o detectado | Si |
| N3 | 4 o más nodos afectados o cualquier número de metástasis en tránsito, satélites y/o microsatélites con 2 o más nodos afectados o cualquier número de nodos apelmazados con o sin metástasis en tránsito, satélites y/o microsatélites. | |
| N3a | 4 o más nodos clínicamente ocultos | No |
| N3b | 4 o más nodos afectados con al menos 1 clínicamente detectados o la presencia de cualquier número de nodos apelmazados. | No |
| N3c | 2 o más nodos clínicamente ocultos o clínicamente detectados y/o la presencia de cualquier número de nodos apelmazados. | Si |
Adaptado de: Gershenwald JE, Scolyer RA, Hess KR, edition cancer staging manual. CA Cancer J Clin. et al. Melanoma staging: Evidence-based changes 2017;67(6):472-492. doi:10.3322/caac.21409 in the American Joint Committee on Cancer eighth
Tabla 3 CRITERIOS M
| CRITERIOS (M) | ||
|---|---|---|
| CATEGORÍA M | SITIO ANATÓMICO | NIVELES DE LDH |
| M0 | Sin ev'dencia de metástasis a distancia | No aplica |
| M1 | Ev'dencia de metástasis a distancia | |
| M1a | Metástasis a distancia a piel, músculo y/o ganglios no regionales | No registrado/Inespecífico |
| M1a (0) | No elevado | |
| M1a (1) | Elevado | |
| M1b | Metástasis a distancia a pulmón con o sin ev'dencia de metástasis M1a | No registrado/Inespecífico |
| M1b (0) | No elevado | |
| M1b (1) | Elevado | |
| M1c | Metástasis a distancia visceral con o sin evidencia de metástasis M1a o M1b | No registrado/Inespecífico |
| M1c (0) | No elevado | |
| M1c (1) | Elevado | |
| M1d | Metástasis a distancia a CNC con o sin evidencia de metástasis M1a, M1b o M1c | No registrado/Inespecífico |
| M1d (0) | No elevado | |
| M1d (1) | Elevado | |
Adaptado de: Gershenwald JE, Scolyer RA, Hess KR, et al. Melanoma staging: Evidence-based changes in the American Joint Committee on Cancer eighth edition cancer staging manual. CA Cancer J Clin. 2017;67(6):472-492. doi:10.3322/caac.21409
Tabla 4 GUÍA PARA LA ESTADIFICACIÓN
| GUÍA DE ESTADIFICACIÓN | |||
|---|---|---|---|
| T | N | M | ESTADIO |
| Tis | N0 | M0 | 0 |
| T1a | N0 | M0 | IA |
| T1b | N0 | M0 | IB |
| T2a | N0 | M0 | IB |
| T2b | N0 | M0 | I IA |
| T3a | N0 | M0 | I IA |
| T3b | N0 | M0 | IIB |
| T4a | N0 | M0 | IIB |
| T4b | N0 | M0 | IIC |
| Cualquier T, Tis | >N1 | M0 | III |
| Cualquier T | Cualquier T | M1 | IV |
Adaptado de: Gershenwald JE, Scolyer RA, Hess KR, et al. Melanoma staging: Evidence-based changes in the American Joint Committee on Cancer eighth edition cancer staging manual. CA Cancer J Clin. 2017;67(6):472-492. doi:10.3322/caac.21409
La categoría (T) es definida por el grosor tumoral en milímetros y la presencia de ulceración. Los límites en el grosor continúan siendo 1.0, 2.0 y 4.0 mm con una ligera variación para la categoría T1. En la octava edición se incluyeron, en la categoría T1, aquellos tumores con un grosor <0.8 mm sin ulceración, mientras que T1b incluye aquellos con grosor entre 0.8-1.0 mm con o sin ulceración o <0.8 mm con presencia de ulceración .
(N) es definida como la presencia de metástasis regional nodal clínicamente oculta (N1a, N2a, N3a) o clínicamente detectada (N1b, N2b, N3b). También hace parte de la categoría la presencia de metástasis regional no nodal, la cual comprende hallazgos tales como microsatélites, satélites o metástasis en tránsito (N1c, N2c, N3c según el número de ganglios linfáticos regionales comprometidos) .
El compromiso metastásico a distancia o (M), continúa definido como la presencia de metástasis en alguno de los siguientes sistemas: (M1a) piel, tejido celular subcutáneo, músculo, ganglios a distancia; (M1b) pulmón; (M1c) visceral; (M1d) sistema nervioso central. En cuanto a los niveles de LDH (lactato deshidrogenasa), continúan siendo importantes para la categorización y debe designarse como "0" si no se encuentra elevado y "1" si se encuentra elevado.
Tratamiento
El tratamiento del Melanoma Lentiginoso Acral se relaciona directamente con la estadificación. Dependiendo del compromiso local, regional y sistémico, el enfoque terapéutico es diferente. Dada la longitud y complejidad del tópico, se require la ampliación del mismo en una publicación futura.
En términos generales, en estadios tempranos el manejo del MLA es principalmente quirúrgico por medio de una escisión local amplia que permita asegurar márgenes libres de tumor. Para esto, la AJCC recomienda márgenes de 0.5-1 cm para melanoma in situ, 1 cm para tumores menores de 1.0 mm, de 1-2 cm para tumores con grosor entre 1.02.0 mm y de 2 cm para melanomas mayores de 4.0 mm o con componente invasor 79. Se podrá o no requerir de amputación y de un cirujano plástico que pueda realizar la reconstrucción del sitio quirúrgico mediante colgajos u otras técnicas 69.
Es de importancia mencionar que el melanoma lentiginoso acral puede tener una importante extensión subclínica y por esta razón está indicada la Cirugía de Mohs, considerándolo un melanoma de sitio especial .
Según el estudio de nodos linfáticos, mediante la realización de ganglio centinela, se definirá la necesidad de linfadenectomía completa o disección linfática terapéutica; sin embargo, se ha establecido que la linfadenectomía completa ofrece una mejor sobrevida .
En los casos de melanoma avanzado con compromiso metastásico, existen opciones terapéuticas como los inhibidores de BRAF y MEK (dabrafenib y trametinib); los inhibidores de puntos de control inmunitarios como los anti-PD-1 y anti-CTLA-4 (pembrolizumab, ipililumab, nivolumab); quimioterapia con DTIC (dacarbazina); Inhibidores de tirosina quinasa (imatinib) y radioterapia. Entre otros tratamientos como intereferón, imiquimod y criocirugía en casos paliativos 68,69,83.
Pronóstico
El melanoma lentiginoso acral tiene una sobrevida 1020% más baja que otros melanomas 84. Diferentes estudios han analizado de forma retrospectiva los factores que influyen en el pronóstico del MLA; algunos sugieren que el MLA representa un subtipo de melanoma biológicamente más agresivo y con un peor pronóstico .
En una cohorte publicada recientemente en población caucásica, en la cual se incluyeron 2.050 pacientes, se encontró que el MLA tiene un mal pronóstico, similar al del melanoma nodular; esto probablemente se debe a la demora en la detección. Al diagnóstico se encuentra un alto grosor tumoral (Breslow), una alta proporción de ulceración y de casos metastásicos 3,87.
En el estudio de Lino-Silva en México, se incluyeron 1.219 melanomas, de los cuales, el 44.1% (538 pacientes) correspondían a MLA, con una mediana de Breslow de 6.01 mm. La supervivencia específica de la enfermedad a 5 años fue del 43.3% en los melanomas acrales, comparada con el 62% en los melanomas no acrales 17.
En una cohorte de 90 pacientes, publicada en el Instituto Nacional de Cancerología en Bogotá, Colombia, la supervivencia global a 5 años del MLA reportada es del 54%, y corresponde al 13.3% de pacientes con Breslow menor de 1 mm y 52.1% de pacientes con Breslow mayor de 2 mm. Esta supervivencia relativamente baja puede explicarse por la mayor proporción de pacientes con estadio avanzado de la enfermedad en el momento del diagnóstico 40.
Aunque existen estudios que evidencian que el nivel socioeconómico, relacionado con la raza en población americana, impacta en la sobrevida del MLA 84, otros no han encontrado una asociación entre la raza/etnia y la sobrevida del MLA 16.
Los resultados de estudios en diferentes poblaciones concluyen en un mismo punto: la baja supervivencia del MLA es secundaria al diagnóstico tardío, es decir, melanomas con mayor grosor, ulceración y peores factores pronósticos. Aun así, faltan estudios que incluyan subtipos moleculares, de perfil inmune, metilación de DNA y expresión genética 88.
Diagnosticar el melanoma acral en su etapa temprana es de vital importancia, teniendo en cuenta la posible relación entre el estadio clínico al diagnóstico y la supervivencia. Esto hace necesario mejorar el entrenamiento del personal de salud para reconocer las lesiones sugestivas de malignidad desde los niveles más básicos de atención en nuestro país















