Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Actualidades Biológicas
versão impressa ISSN 0304-3584
Actu Biol v.32 n.92 Medellín jan./jun. 2010
ARTÍCULOS DE INVESTIGACIÓN
EFECTO DE LOS CAMPOS ELÉCTRICOS SOBRE LA PRODUCCIÓN DE BIOMASA MICELIAL DEL HONGO MEDICINAL GANODERMA LUCIDUM
[(W. CURT.: FR.) P. KARST. (GANODERMATACEAE)]
EFFECT OF ELECTRIC FIELDS ON BIOMASS PRODUCTION OF THE MEDICINAL FUNGUS GANODERMA LUCIDUM
[(W. CURT.: FR.) P. KARST. (GANODERMATACEAE)]
David A. Ramírez-Cadavid1; Andrés R. Galindo-Muñoz2; Paola A. Zapata-Ocampo3; Diego F. Rojas-Vahos4; Carlos Fernández-Ossa5; Lucía Atehortúa-Garcés6
1 Grupo de Biotecnología. Sede de Investigación Universitaria. Universidad de Antioquia. A. A. 1226. Medellín (Antioquia), Colombia. darax83@gmail.com.
2 Facultad de Ingeniería. Departamento de Ingeniería Eléctrica, Bloque 19. Universidad de Antioquia. A. A. 1226. Medellín (Antioquia), Colombia. andresgali@gmail.com.
3 Grupo de Biotecnología. Sede de Investigación Universitaria. Universidad de Antioquia. A. A. 1226. Medellín (Antioquia), Colombia. paozapata@gmail.com.
4 Grupo de Biotecnología. Sede de Investigación Universitaria. Universidad de Antioquia. A. A. 1226. Medellín (Antioquia), Colombia. diferova@gmail.com.
5 Departamento de Ciencias Básicas. Escuela de Ingeniería de Antioquia. A. A. 7516. Envigado (Antioquia), Colombia. pfcafer@eia.edu.co.
6 Docente. Instituto de Biología, Diversidad de Antioquia. Universidad de Antioquia. A. A. 1226. Medellín (Antioquia), Colombia. latehor@gmail.com
Resumen
Se evaluó el efecto de los campos eléctricos sobre el crecimiento del hongo Ganoderma lucidum [(W. Curt.: Fr.) P. Karst. Ganodermataceae] bajo condiciones de cultivo sumergido, con el objetivo de optimizar su producción de biomasa. Ganoderma lucidum fue expuesto a tres factores diferentes [tipo de campo eléctrico corriente alterna (AC), corriente continua (DC) y corriente pulsada (IM)]; intensidad del campo [siete intensidades de campo desde 0,0 kV cm-1] (cultivo control) hasta 3,0 kV cm-1; y periodo de estimulación [dependiendo de la fase de crecimiento del hongo, después de la inoculación día 0 (fase lag), día 3 (fase exponencial o log) y día 6 (fase estacionaria)].
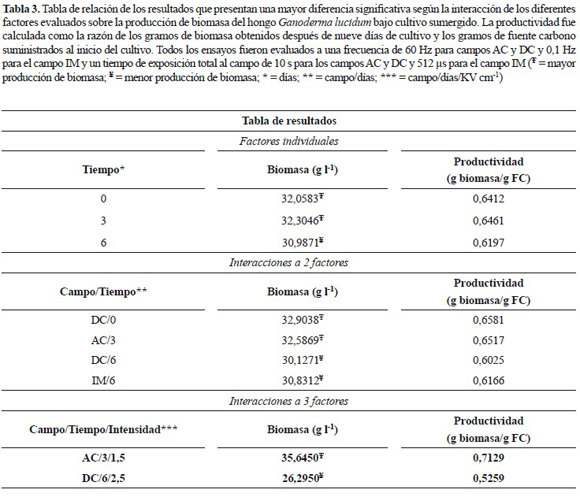
Los resultados mostraron que la combinación del campo eléctrico AC, con una intensidad de 1,5 kV cm-1 y aplicado al día 3 presentaron una mejor producción de biomasa con una media de 35,6450 ± 0,6684 gl-1, mientras que la combinación de los tres factores tipo de campo eléctrico DC a una intensidad de 2,5 kV cm-1 y aplicado el día 6 presentaron una menor producción de biomasa con una media de 26,2950 ± 3,9926 gl-1. Los anteriores resultados muestran que según la combinación de los factores evaluados es posible estimular la producción de biomasa del hongo Ganoderma lucidum bajo condiciones de cultivo sumergido mediante la aplicación de campo eléctrico.
Palabras clave: campo eléctrico, cultivo sumergido, Ganoderma lucidum, producción de biomasa
Abstract
The effect of electric fields on the growth of the fungus Ganoderma lucidum [(W. Curt.: Fr) P. Karst. Ganodermataceae] under submerged culture was evaluated in order to optimize the production of biomass. Ganoderma lucidum was exposed to three different factors, types of electric fields [alternating current (AC), direct current (DC) and pulsed current (IM)], field intensities from 0.0 kV cm-1 (control culture) to 3.0 kV cm-1, stimulation period depending on the growth phase of the fungus after inoculation: day 0 (lag phase), day 3 (exponential or log phase) and day 6 (stationary phase). Results showed that the combination of three factors: AC electric field at an intensity of 1.5 kV cm-1 applied at day 3 day the highest biomass production with an average of 35.6450 ± 0.6684 gl-1, whereas the combination of DC electric field at an intensity of 2.5 kV cm-1 applied at day 6 showed the lowest production of biomass with an average of 26.2950 ± 3.9926 gl-1. These results show that depending on the combination of evaluated factors, the production of biomass of the fungus Ganoderma lucidum in submerged culture conditions may be stimulated by applying electric fields.
Key words: biomass production, electric field, Ganoderma lucidum, submerged culture
INTRODUCCIÓN
Ganoderma lucidum [(W. Curt.: Fr.) P. Karst. (Ganodermataceae)] es un hongo medicinal que tiene una tradición de uso de más de 2.000 años de antigüedad, especialmente en China y Japón donde es conocido como Lingzhi y Reishii o Mannetake, respectivamente (Yang et al. 2003). Su uso en estas culturas se ha basado principalmente en el tratamiento de ciertas dolencias y enfermedades (Berovic et al. 2003). Solo en las últimas décadas este organismo se ha venido investigando de manera sistemática en la medicina occidental y oriental, lo que ha permitido encontrar gran cantidad de compuestos y metabolitos activos con efectos biológicos, los cuales son obtenidos a través del cultivo de G. lucidum. Estos compuestos son principalmente los polisacáridos β-(1-3)-glucanos y β-(1-6)-glucanos (Daniel 2004, Huie y Di 2004, Yang et al. 2010), los triterpenos como los ácidos ganodéricos A, B, T y Me (Gao et al. 2002, Hirotani et al. 1987, Hirotani et al. 1985, Tang et al. 2006), entre otros componentes, los cuales presentan alta actividad fisiológica-metabólica reflejada en una creciente evidencia científica, destacándose las siguientes propiedades: antihepatitis (Campos et al. 2006, Lin 2005, Lin et al. 2003), antiinflamatoria (Akihisa et al. 2007, Ko et al. 2008, Patocka 1999), anti-HIV (El-Mekkawy et al. 1998, Min et al. 1998), hipoglucemiante (Hikino et al. 1989), hipocolesterolémica (Berger et al. 2004, Hajjaj et al. 2005), antiandrogénica (Liu et al. 2007), hepatoprotectora (Zhang et al. 2002), actividad antitumoral y anti-angiogénesis (Cao y Lin 2004, Chen et al. 2004, Song et al. 2004, Stanley et al. 2005) e inmunomoduladora (Lin 2005, Liu et al. 2003).
Como consecuencia de lo anterior la demanda de cuerpos fructíferos y productos a partir de G. lucidum ha aumentado, incentivando la búsqueda de diferentes estrategias con el fin de optimizar los procesos fermentativos en estado líquido, cuyas ventajas con respecto al cultivo tradicional o sólido radican en la reducción de tiempo de cultivo para la obtención de productos de interés a la vez que se garantiza una composición homogénea de ellos (Wagner et al. 2003). Algunas de estas estrategias, encaminadas a la optimización de los procesos fermentativos a nivel de erlenmeyer y de biorreactor son, por ejemplo, el control de factores ambientales como el pH y la tensión de oxígeno (Tang et al. 2009), o la modificación del medio de cultivo con la adición de aditivos poliméricos (poliacrilamida y alginato) (Yang et al. 2003) y el uso de aceites vegetales y ácidos grasos (Wagner et al. 2003), entre otras. A pesar de todas las investigaciones llevadas a cabo con el propósito de incrementar la producción de biomasa y metabolitos del hongo G. lucidum en cultivo sumergido, a la fecha, no existen reportes sobre la aplicación de campos eléctricos con este propósito.
El estudio de los campos eléctricos y sus efectos sobre organismos se ha venido llevando a cabo desde el siglo xviii hasta nuestros días. Aunque muchos estudios han reportado efectos benéficos, los resultados han sido inconsistentes y en algunos casos contradictorios (Shigemitsu 1999). Este tipo de resultados se presenta debido a las repuestas que tienen los diferentes organismos a los campos eléctricos, ya que estas dependen del organismo y su estructura, el medio de crecimiento en el cual se encuentre, la fuerza del campo, el tiempo de exposición, la forma y frecuencia del campo, entre otros factores (Berg 1993, 1995, Dimitrov et al. 2002, Hülsheger et al. 1981, Ohshima et al. 2007).
Durante las últimas décadas el uso benéfico de estos campos en la biología y en la medicina es bastante conocido y aplicado, además de la electroporación de membranas celulares, el uso de la electroestimulación del metabolismo celular por campos eléctricos o electromagnéticos es una nueva herramienta en procesos no invasivos de estimulación a organismos vivos. Ejemplos de los procesos investigados incluyen proliferación de organismos, reacciones enzimáticas, síntesis de biopolímeros, cambios morfológicos, fenómenos de transporte de membrana (Berg 1993, 1995) y regeneración de tejido óseo (Tsong 1990).
En la biología, los efectos estimulantes de los campos han sido objeto de investigación desde hace varias décadas, por ejemplo, estudios para la estimulación del crecimiento por campos eléctricos en plantas de frijol y maíz han sido realizados desde la década de los 60 (Murr 1966) y el uso en hongos se ha reportado desde la década de los 50 según Takaki et al. (2009), pero solo durante las últimas tres décadas las investigaciones en este campo se han venido diversificando y cada vez son más comunes.
Ejemplo de ello es el uso de electroestimulación para mejorar el crecimiento de algunas plantas y la fructificación de hongos en sustratos sólidos en diversos sistemas de cultivos agrícolas, los cuales han logrado estimular el crecimiento de plantas, como el tomate, la lechuga, la fresa y varias clases de flores, entre otras (Cogalniceanu et al. 1998, Pohl y Todd 1981). Igualmente el uso de campos eléctricos en sistemas de cultivos convencionales y en fermentaciones en estado sólido de algunos hongos ha logrado disminuir el tiempo para el desarrollo de cuerpo fructífero de algunas especies como: Grifola frondosa y Pleurotus ostreatus, además de otras clases de hongos (Jitsufuchi y Yamamoto 1987, Ohga et al. 2004, Ohga y Iida 2001a, b, Takaki et al. 2009). También, el uso de electroestimulación ha sido probado en fermentaciones en estado líquido de algunos organismos para mejorar sus rendimientos, entre los cuales se encuentran Pseudomonas stutzeri durante procesos de desnitrificación (Hönes et al. 1998), Streptomyces noursei durante procesos fermentativos para la producción de antibióticos (Grosse et al. 1988), Saccharomyces cereviseae utilizado en fermentaciones para la producción de alcohol (Nakanishi et al. 1998), Thricoderma reesei usado en fermentaciones para la producción de enzimas celulolíticas (Kerns et al. 1993), entre otros.
Partiendo de los resultados mostrados anteriormente sobre el potencial de los campos eléctricos para estimular el crecimiento de diferentes especies de plantas y de hongos producidos tanto en cultivo sólido como líquido, y a falta de evidencia científica que muestre el efecto del campo eléctrico en cultivos de hongos bajo condiciones sumergidas (fermentación líquida), el presente proyecto abordó el estudio del efecto del campo eléctrico en la producción de biomasa micelial de G. lucidum bajo cultivo sumergido. Los ensayos evaluaron el efecto de 3 tipos de campos eléctricos; 8 intensidades de campo y el tiempo de aplicación en 3 días diferentes durante el periodo de crecimiento del hongo empleando un diseño estadístico factorial categórico 32 x 8, completamente aleatorio con 4 réplicas por tratamiento.
MATERIALES Y MÉTODOS
Mantenimiento de la cepa. La cepa de G. lucidum (Ganodermataceae) fue obtenida del cepario del Laboratorio de Biotecnología de la Universidad de Antioquia. La cepa de G. lucidum fue mantenida y replicada en agar PDA, incubado a 26 °C bajo condiciones de oscuridad durante 15 días y posteriormente fue transferido a una temperatura de 4 °C.
Preparación de preinóculos. El medio para la preparación del preinóculo de G. lucidum fue desarrollado en el Laboratorio de Biotecnología de la Universidad de Antioquia (Zapata, 2007) y consistió en los siguientes componentes (gl-1): fuente de carbono compleja, 50; NaNO3, 0,08; MgSO47H2O, 0,02; KH2PO4, 0,03; KCl, 0,01. Los preinóculos fueron preparados en erlenmeyers de 250 ml conteniendo 50 ml de medio líquido con pH inicial de 5,6 ± 0,1 e inoculados con un disco de 1 cm de diámetro de micelio y agar, bajo condiciones asépticas. Los erlenmeyers fueron incubados a 100 rpm, 26 ± 1 °C y 3,67 micromol m-2s-1 durante 5 días y luego fueron almacenados a 4 °C, con el objetivo de preservar el inóculo antes de su uso.
Cultivos en matraz. Los cultivos de G. lucidum se realizaron en erlenmeyers de 250 ml conteniendo 50 ml de medio descrito anteriormente (Zapata 2007). Cada erlenmeyer fue inoculado con 1 g en peso fresco de biomasa micelial de G. lucidum obtenido a partir del preinóculo, previo a la inoculación los preinóculos fueron activados a temperatura ambiente durante 24 h, y luego los cultivos fueron incubados a un agitador orbital a 100 rpm, 26 ± 1 °C y 3,67 micromol m-2s-1 durante 9 días.
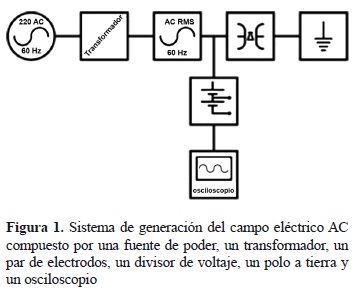
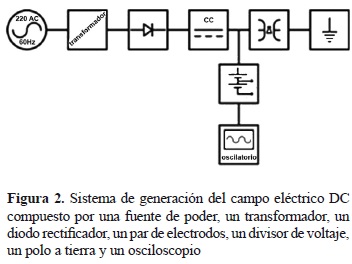
Sistema de generación de campos eléctricos. Los cultivos de Ganoderma lucidum fueron sometidos a campos eléctricos cuyas características dependían del tipo de corriente que los generaba: corriente alterna (AC), corriente directa (DC) y corriente pulsada (IM), las cuales generan respectivamente los campos eléctricos: AC, DC e IM. Los sistemas utilizados para la generación de estos campos son descritos a continuación. El sistema de generación para los campos AC y DC constaba de un transformador de alta tensión monofásico (Sierra®, 10 KVA, 220 a 110 kV, monofásico, refrigerado en aceite) conectado a un equipo regulador de voltaje (De Lorenzo® DL1059), la señal generada fue transmitida hasta un par de electrodos construidos en acero inoxidable de dimensiones 70 x 45 x 20 cm con extremos y puntas curvadas con un radio de 10 cm. Para el campo DC, la señal AC fue rectificada por un diodo rectificador (150 kV, 500 mA con un filtro capacitivo de 50 pF, 200 kV). El seguimiento y la visualización de las señales fue hecho mediante el acople de un divisor de voltaje capacitivo de alta tensión de 2.000 (Hipotronics® KVM200, 200 kV RMS) y un osciloscopio digital (Fluke® 199). Los esquemas del montaje realizado para generar, seguir y visualizar el campo AC y el campo DC son mostrados en las figuras 1 y 2, respectivamente.
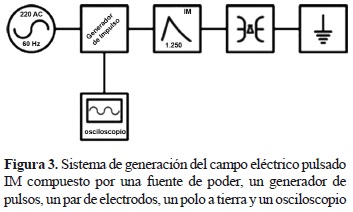
El campo pulsante fue obtenido mediante un generador de impulsos de tensión (Passoni Villa® GTP 32, onda normalizada 1,2/50 μs hasta 32 kV pico) cuyo impulso de tensión fue una onda normalizada 1,2/50 μs, conectado a un par de electrodos. El seguimiento y visualización de la señal fue realizada mediante un divisor de tensión interno en el equipo de relación por 1.875 y un osciloscopio digital (Fluke® 199) (figura 3).
Evaluación del efecto del tipo de campo eléctrico sobre el crecimiento del hongo G. lucidum en diferentes etapas del ciclo de cultivo del hongo. Se evaluaron los tres tipos de campo eléctrico sobre la producción de biomasa en diferentes etapas del ciclo de cultivo de G. lucidum. La curva de crecimiento del hongo durante 14 días de cultivo en condiciones de laboratorio muestra las diferentes fases de crecimiento del organismo: fase lag entre días 0 y 2, fase exponencial o log entre días 2 y 5, fase estacionaria entre días 5 y 8 y fase de muerte celular después del día 8 (Zapata 2007). Los tres tipos de campo eléctrico fueron aplicados en los días 0, 3 y 6, ya que estos días están dentro de los límites de tiempo de las tres primeras fases de crecimiento del organismo.
Para la aplicación del campo eléctrico los erlenmeyers fueron suspendidos entre los electrodos a una distancia de 1 cm de cada uno de ellos y fueron ubicados centralmente para garantizar que estuvieran sometidos a un campo lo más homogéneo posible.
Los campos AC (medido en RMS) y DC se aplicaron durante un tiempo de 10 s para cada tratamiento y el campo IM fue aplicado en 10 pulsos con un tiempo de 10 s entre pulso. La intensidad del campo suministrado tuvo valores de 0,0 (cultivo control), 0,1, 0,5, 1,0, 1,5, 2,0, 2,5 y 3,0 kV cm-1, para cada tipo de campo eléctrico utilizado. Las condiciones ambientales para la aplicación de los campos fueron de 24,5 °C y un porcentaje de humedad de 84%.
Cuantificación de la biomasa micelial. La cuantificación de la biomasa producida durante los cultivos de Ganoderma lucidum se realizó utilizando el método del peso seco, descrito por Tang y Zhong (2002). La biomasa micelial fue filtrada en un tamiz 35 (US standard mesh number 35) con diámetro de poro de 500 μm. El micelio fue lavado con abundante agua destilada para remover las partículas de material insoluble, después las muestras fueron depositadas en caja de petri y secadas en horno a una temperatura de 60 °C durante 72 horas hasta peso constante, los resultados fueron registrados en gl-1.
Diseño estadístico. El diseño experimental realizado fue un diseño factorial categórico 32 x 8, completamente aleatorio con 4 réplicas por tratamiento. Cada uno de los factores evaluados: el tipo de campo eléctrico en 3 niveles diferentes, campo AC, campo DC y campo IM; el tiempo de aplicación del campo eléctrico sobre las muestras en 3 niveles, días 0, 3 y 6; y la intensidad del campo eléctrico en 7 niveles, 0,0 (cultivo control), 0,1, 0,5, 1,0, 1,5, 2,0, 2,5 y 3,0 kV cm-1, fueron analizados individualmente, al igual que sus interacciones a dos y tres factores, para determinar el efecto sobre la producción de biomasa. La variable respuesta fue la concentración biomasa micelial (gl-1) obtenida luego de nueve días de cultivo. El diseño fue evaluado por medio del software estadístico StatGraphics Centurion® XV.
RESULTADOS
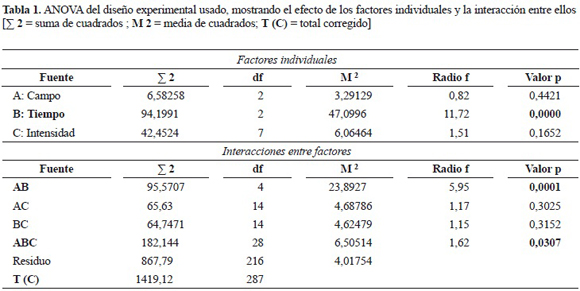
El análisis de varianza (ANOVA) permite ver la incidencia de los tres factores evaluados de manera individual y las interacciones entre ellos sobre la producción de biomasa (tabla 1). El valor P < 0,05 con un nivel de confianza del 95% muestra como el factor tiempo, y las interacciones campo eléctrico/tiempo de aplicación, y campo eléctrico/tiempo de aplicación/intensidad del campo eléctrico tienen incidencia significativa sobre la producción de biomasa.
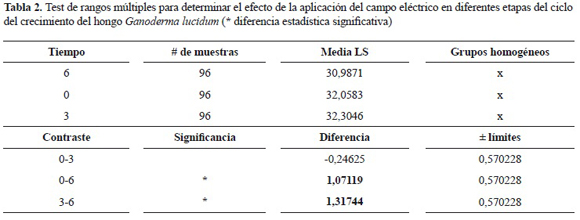
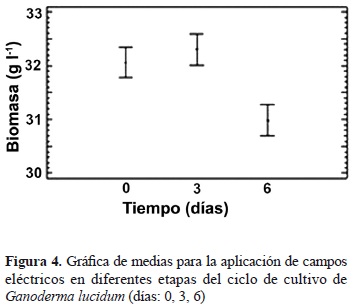
El efecto de los factores analizados individualmente muestra que el tiempo de aplicación del campo eléctrico, ya sea AC, DC o IM en cualquiera de las intensidades evaluadas, en diferentes etapas del ciclo de cultivo de G. lucidum tiene un efecto significativo con un valor P = 0,00, por el contrario los otros factores no muestran efectos significativos pues sus valores P están por encima del valor máximo de 0,05 (tabla 1). La prueba de rangos múltiples para el factor tiempo muestra 2 grupos homogéneos, uno de estos que agrupa los días 0 y 3, y el otro contiene el día 6 (tabla 2). Este último grupo presentó un valor medio significativamente menor en la producción de biomasa, 30,9871 ± 2,5184 gl-1, comparado con los días 0 y 3 los cuales presentan un valor promedio de 32,0583 ± 1,9580 gl-1 y 32,3046 ± 1,9417 gl-1, respectivamente, presentándose la mejor media absoluta en el nivel 3 sin que esta presente diferencia estadística con el día 0 (figura 4).
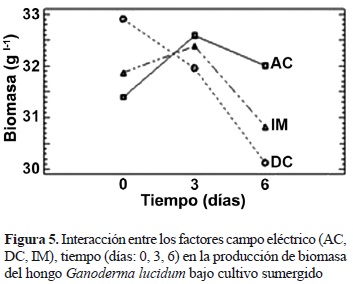
El análisis de interacción entre los factores, a partir del análisis ANOVA, muestra que solamente la interacción entre el tipo de campo eléctrico aplicado y el tiempo de aplicación del campo en diferentes etapas del ciclo de cultivo presentó un efecto significativo en la producción de biomasa (tabla 1). Entre el grupo de interacciones evaluadas mediante un análisis de medias, cabe resaltar que el campo eléctrico DC aplicado al día 0, muestra una producción de 32,9038 ± 1,7098 gl-1 y el campo eléctrico AC aplicado al día 3, tiene una producción de 32,5869 ± 1,9489 gl-1, estas combinaciones de factores presentaron las mejores medias absolutas. Es notable a la vez cómo la aplicación de un campo eléctrico al día 6 disminuye la producción de biomasa, sobre todo la aplicación del campo eléctrico DC e IM, obteniéndose valores de 30,1271 ± 3,1111 gl-1 y 30,8312 ± 1,7781 gl-1, respectivamente.
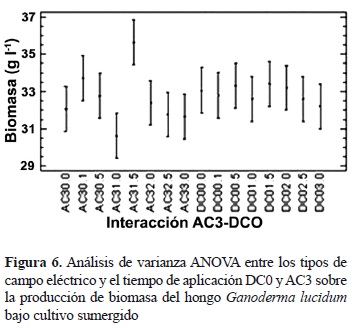
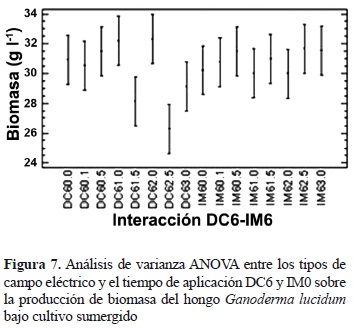
Según este análisis y observando la figura de interacción a dos factores (figura 5), se puede concluir que los mejores resultados se presentan bajo los factores DC y AC aplicados a los días 0 (fase lag) y 3 (fase log), respectivamente, y que los resultados que presentan valores más bajos de producción se encuentran bajo el efecto de los factores de los campos DC e IM al día 6 (fase estacionaria), como se había dicho anteriormente. Con el propósito de depurar estos resultados, se llevaron a cabo dos análisis de varianza independientes, el primero relaciona los tratamientos DC aplicado al día 0 y AC aplicado al día 3, y el segundo agrupa los tratamientos DC e IM aplicados al día 6, con el objetivo de identificar entre cada grupo de interacción a dos factores la mejor y la menor producción de biomasa respectivamente (figuras 6 y 7). Los análisis de varianza para estas dos pruebas arrojaron valores P iguales a 0,09 y 0,05 (tablas no presentadas), lo cual indica que estas pruebas no muestran diferencias estadísticas significativas entre las interacciones analizadas. A partir de lo anterior, cabe resaltar que aunque las interacciones evaluadas anteriormente no presentan diferencias significativas, estas reportan las mayores y las menores producciones de biomasa, respectivamente, por lo que la aplicación de un campo DC al día 0 o de un campo AC al día 3, dentro de las intensidades evaluadas, del ciclo de cultivo del hongo G. lucidum, se vería traducida en un aumento de la producción de biomasa, asimismo, la aplicación de un campo DC e IM al día 6, dentro de las intensidades evaluadas, llevaría a una disminución en la producción de biomasa de este hongo.
A pesar de los resultados presentados anteriormente, es notable cómo la interacción de los tres factores: tipo de campo eléctrico, tiempo de aplicación del campo eléctrico en diferentes etapas del ciclo de cultivo y la intensidad del campo, presentan diferencia significativa en la producción de biomasa (tabla 1). A partir de estos resultados, se realizó un análisis de varianza global en un solo bloque para analizar la interacción de los tres factores combinados de manera específica, con el objetivo de comparar los tratamientos entre ellos. Los resultados muestran que existen 14 grupos homogéneos y entre ellos se puede destacar que la mayor media absoluta en la producción de biomasa se obtuvo mediante la aplicación del campo eléctrico AC, a una intensidad de 1,5 kV cm-1, al tercer día después de inocular la muestra, ya que la media registrada fue de 35,6450 ± 0,6684 gl-1, es notable además cómo la interacción del campo eléctrico DC, a una intensidad de 2,5 kV cm-1 aplicado al día 6 después de inoculadas las muestras, presenta la menor media absoluta registrada en 26,2950 ± 3,9926 gl-1 (resultados no presentados).
DISCUSIÓN
Los resultados muestran efecto significativo de los factores evaluados en la producción de biomasa micelial del hongo medicinal G. lucidum en cultivos sumergidos a nivel de matraz. El análisis de los factores indica que solamente la aplicación del campo eléctrico en diferentes etapas del ciclo de cultivo de este hongo, especialmente durante la fase exponencial o log (día 6), tiene diferencia significativa sobre los otros factores analizados de manera individual, además, el análisis de interacción entre los diferentes factores indica que: el tipo de campo eléctrico/tiempo de aplicación y el tipo de campo eléctrico/tiempo de aplicación/intensidad del campo, presentan diferencia significativa sobre los demás tipos de interacciones. Los resultados más importantes se relacionan en la tabla 3.
Entre la literatura consultada son pocos los artículos que muestran el efecto de la electroestimulación durante las fases de crecimiento de un organismo, sin embargo, es notable cómo los organismos son más sensibles a este tipo de fenómenos durante las fases tempranas del crecimiento celular (principalmente fase log), por ejemplo, durante la estimulación por campos de Strectomyces noursei para la producción de antibióticos por medio de un campo con forma de onda cuadrática a una intensidad de 1,5 mV cm-1, el efecto estimulante se obtuvo principalmente por la estimulación de las ratas metabólicas del organismo que llevan a que este aproveche los nutrientes que se encuentran en el medio de cultivo más fácil y rápidamente, a través del incremento en el número de enzimas que pueden facilitar este proceso y a un cambio positivo en los flujos iónicos de membrana, que aunque comunes en esta etapa, llegan a ser estimulados por lo campos (Berg 1993, Grosse et al. 1988), el mismo caso fue reportado durante el establecimiento de condiciones de estimulación para la optimización de la división celular en Saccharomyces cerevisiae, específicamente por medio de un campo AC con una forma de onda cuadrada a una intensidad de 0,85 kV cm-1 (Fologea et al. 1998), sin embargo, dependiendo de las características del campo aplicado, los efectos que se pueden obtener pueden ser negativos, es el caso de las células de S. cerevisiae que mostraron efectos negativos, inhibición del crecimiento celular, cuando fueron sometidas a campos eléctricos pulsados de alta intensidad (35 kV cm-1). Lo anterior coincide con los resultados mostrados en la tabla 1, según los cuales hubo una sensibilidad mayor a la estimulación en el crecimiento de G. lucidum cuando los campos fueron aplicados durante fases tempranas de crecimiento, de igual manera es apreciable cómo los campos aplicados durante la fase estacionaria de este hongo tienen efecto negativo, siendo notable que la aplicación de cualquier tipo de campo durante esta fase conlleva la disminución notable en la producción de biomasa.
Los efectos tanto positivos como negativos de la combinación de los factores tipo de campo eléctrico/tiempo de aplicación, pueden ser debidos al efecto que tiene la aplicación del campo durante las etapas de crecimiento celular del hongo y a que según el tipo de campo eléctrico utilizado los organismos responden de manera diferente; la aplicación de campos eléctricos a partir de corrientes pulsadas (IM), ya sean rectangulares o exponenciales decrecientes, siendo esta última la forma de onda del campo IM utilizado durante este proyecto, sobre cultivos celulares o células en medios líquidos generan cambios dramáticos en las células y tejidos que son sometidos a ellos; este tipo de fenómeno es conocido como electroporación, electrofusión o electrotransformación y disminuye la viabilidad celular por medio de la ruptura irreversible de la membrana plasmática (Berg 1993). Este tratamiento es muy utilizado en las áreas de esterilización de alimentos y transformaciones genéticas, donde las intensidades del campo pueden ir desde 1 kV cm-1 hasta los 100 kV cm-1 (Mazurek et al. 1995). Sin embargo, la aplicación de corrientes alternas que generan campos AC o corrientes directas que generan campos eléctricos DC durante el crecimiento celular llega a ser un importante factor de estimulación del metabolismo, actuando en la fisiología, la genética y la bioquímica celular, donde este tipo de campos han reportado efectos positivos, debido principalmente a la producción de metabolitos y a la activación de la replicación y transcripción durante la expresión de genes (Berg 1993). Según lo anterior, los resultados obtenidos son acordes a la literatura, ya que los campos aplicados durante una fase temprana de crecimiento celular tuvieron efectos positivos sobre la producción de biomasa de G. lucidum, como se había mencionado antes, a la vez los campos AC y DC mostraron mayores efectos positivos al ser aplicados durante estas fases de crecimiento, mientras que el campo IM presentó efectos negativos; acorde con lo anterior fueron los resultados mostrados por todos los campos aplicados durante la fase estacionaria, los cuales presentaron efectos negativos (figura 5).
El efecto combinado de los tres factores evaluados es aún más difícil de explicar, pero según la literatura, cada organismo depende de muchos factores para poder ser estimulado o de manera contraria, inhibido en su crecimiento. Las ''ventanas de campo'' (field-windows), nombre dado principalmente a las respuestas presentadas en el transporte de membrana y en algunos procesos celulares en un organismo por ''ventanas eléctricas'' (electric windows), las cuales reúnen tres parámetros del campo eléctrico: frecuencia, amplitud (relacionado con la intensidad) y duración, pueden llegar a ser negativas o positivas, si se inhibe o estimula el crecimiento celular, respectivamente (Berg 1999). Es bastante conocido que en general los campos de bajas frecuencias (< 100 Hz) tienen efectos estimulantes en la mayoría de los organismos (Berg 1993), mientras que los otros factores deben ser evaluados de manera específica, al igual que los factores ambientales, como temperatura, humedad, tiempo de cultivo, etc. (Berg 1999), con el fin de determinar las condiciones apropiadas para la estimulación de un organismo específico por medio de campos eléctricos. En las condiciones en las cuales se desarrolló este proyecto, que dependían de los equipos y las instalaciones que se tenían para realizarlo, se logró identificar la combinación de los factores evaluados a condiciones específicas, que permiten inhibir o estimular el crecimiento del hongo G. lucidum.
Lo anterior implica que el estudio del efecto de los campos eléctricos sobre el crecimiento de hongos en cultivos sumergido es un nuevo horizonte de investigación que vale la pena abordar con todo el rigor y el soporte de las nuevas tecnologías y multidisciplinas, principalmente en el área de elucidación de la mecánica involucrada, a la par de estudios que muestren el efecto no solo en la producción de biomasa, sino también en la producción de metabolitos primarios y secundarios.
CONCLUSIÓN
En el presente estudio se evaluó el efecto de diferentes tipos, intensidades y tiempos de aplicación de campo eléctrico en diferentes etapas del ciclo de cultivo del hongo medicinal G. lucidum con el objetivo de optimizar su producción de biomasa micelial. Se encontró que dependiendo del tiempo de aplicación del campo eléctrico el hongo respondía de manera positiva si el campo era aplicado durante los primeros días de cultivo, generando un incremento en la biomasa. Por otro lado, dependiendo del tipo de campo eléctrico aplicado y del tiempo de aplicación, el hongo respondía de diferente manera, presentando un estímulo en la producción de biomasa si los campos DC y AC se aplicaban a los días 0 y 3, respectivamente. También, el tiempo de aplicación del campo eléctrico, el tipo de campo y la intensidad de este, dieron como resultado mejor respuesta en la producción de biomasa bajo una combinación especial de factores que fueron: la aplicación del campo eléctrico AC al día 3 después de inoculados los medios y a una intensidad de 1,5 kV cm-1, presentando la mejor media absoluta con una producción de biomasa de 35,6450 gl-1 lo que representa un incremento del 22,91%, con respecto al mejor reporte realizado hasta la fecha en la producción de biomasa de G. lucidum bajo cultivo sumergido, aproximadamente 27 gl-1 (Zapata 2007). Lo anterior muestra cómo el campo eléctrico alterno (AC) produce un efecto estimulante para la producción de biomasa de hongos bajo cultivo sumergido a diferencia del campo eléctrico pulsado (IM).
Finalmente, vale la pena resaltar que la aplicación de campos eléctricos AC y DC sobre cultivos líquidos del hongo G. lucidum en fases tempranas del crecimiento, estimulan la producción de biomasa del hongo y abren una nueva alternativa para el estudio del crecimiento y formación de nuevos productos a partir del cultivo de hongos mediante la variación de parámetros físicos no convencionales, como en este caso el campo eléctrico.
AGRADECIMIENTOS
Los autores agradecen al CODI-Universidad de Antioquia por el soporte económico brindado para la realización de este proyecto, a la Escuela de Ingeniería de Antioquia por la asesoría académica brindada para la realización de los análisis estadísticos y al Laboratorio de Alta Tensión de la Facultad de Ingeniería de la Universidad de Antioquia a cargo del profesor Fernando Gallego por las facilidades prestadas durante la realización de este proyecto.
REFERENCIAS
1. Akihisa T, Nakamura Y, Tagata M, Tokuda H, Yasukawa K, Uchiyama E, Suzuki T, Kimura Y. 2007. Anti-inflammatory and anti-tumor-promoting effects of triterpene acids and sterols from the fungus Ganoderma lucidum. Chemistry and Biodiversity, 4: 224-231. [ Links ]
2. Berg H. 1993. Electrostimulation of cell metabolism by low frequency electric and electromagnetic fields. Bioelectrochemistry and Bioenergetics, 31: 1-25. [ Links ]
3. Berg H. 1995. Possibilities and problems of low frequency weak electromagnetic fields in cell biology. Bioelectrochemistry and Bioenergetics, 38: 153-159. [ Links ]
4. Berg H. 1999. Problems of weak electromagnetic field effects in cell biology. Bioelectrochemistry and Bioenergetics, 48: 355-360. [ Links ]
5. Berger A, Rein D, Kratky E, Monnard I, Hajjaj H, Meirim I, Piguet-Welsch C, Hauser J, Mace K, Niederberger P. 2004. Cholesterol-lowering properties of Ganoderma lucidum in vitro, ex vivo, and in hamsters and minipigs. Lipids in Health and Disease, 3: 2. [ Links ]
6. Berovic M, Habijanic J, Zore I, Wraber B, Hodzar D, Boh B, Pohleven F. 2003. Submerged cultivation of Ganoderma lucidum biomass and immunostimulatory effects of fungal polysaccharides. Journal of Biotechnology, 103: 77-Campos D, Noratto G, Chirinos R, Arbizu C, Roca W, Cisneros-Zevallos L. 2006. Antioxidant capacity and secondary metabolites in four species of Andean tuber crops: native potato (Solanum sp.), mashua (Tropaeolum tuberosum Ruiz & Pavon), oca (Oxalis tuberosa Molina) and ulluco (Ullucus tuberosus Caldas). Journal of the Science of Food and Agriculture, 86: 1481-1488. [ Links ]
7. Cao QZ, Lin ZB. 2004. Antitumor and anti-angiogenic activity of Ganoderma lucidum polysaccharides peptide. Acta Pharmacologica Sinica, 25: 833-838. [ Links ]
8. Chen HS, Tsai YF, Lin S, Lin CC, Khoo KH, Lin CH, Wong CH. 2004. Studies on the immuno-modulating and anti-tumor activities of Ganoderma lucidum (Reishi) polysaccharides. Bioorganic and Medicinal Chemistry, 12: 5595-5601. [ Links ]
9. Cogalniceanu G, Radu M, Fologea D, Moisoi N, Aurelia B. 1998. Stimulation of tobacco shoot regeneration by alternating weak electric field. Bioelectrochemistry and Bioenergetics, 44: 257-260. [ Links ]
10. Daniel S. 2004. Cellular and physiological effects of Ganoderma lucidum (Reishi). Mini Reviews in Medicinal Chemistry, 4: 873-879. [ Links ]
11. Dimitrov V, Stoimenova M, Tsoneva I. 2002. Electrically induced concentration fluctuations in Escherichia coli suspensions. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 209: 201-205. [ Links ]
12. El-Mekkawy S, Meselhy MR, Nakamura N, Tezuka Y, Hattori M, Kakiuchi N, Shimotohno K, Kawahata T, Otake T. 1998. Anti-HIV-1 and anti-HIV-1-protease substances from Ganoderma lucidum. Phytochemistry, 49: 1651-1657. [ Links ]
13. Fologea D, Vassu-Dimov T, Stoica I, Csutak O, Radu M. 1998. Increase of Saccharomyces cerevisiae plating efficiency after treatment with bipolar electric pulses. Bioelectrochemistry and Bioenergetics, 46: 285-287. [ Links ]
14. Gao JJ, Min BS, Ahn EM, Nakamura N, Lee HK, Hattori M. 2002. New triterpene aldehydes, lucialdehydes A-C, from Ganoderma lucidum and their cytotoxicity against murine and human tumor cells. Chemical and Pharmaceutical Bulletin, 50: 837-840. [ Links ]
15. Grosse HH, Bauer E, Berg H. 1988. Electrostimulation during fermentation. Bioelectrochemistry and Bioenergetics, 20: 279-285. [ Links ]
16. Grosse HH, Bauer E, Berg H. 1988. Electrostimultaion during fermentation. Bioelectrochemistry and Bioenergetics, 20: 279-285. [ Links ]
17. Hajjaj H, Mace C, Roberts M, Niederberger P, Fay LB. 2005. Effect of 26-oxygenosterols from Ganoderma lucidum and their activity as cholesterol synthesis inhibitors. Applied and Environmental Microbiology, 71: 3653-3658. [ Links ]
18. Hikino H, Ishiyama M, Suzuki Y, Konno C. 1989. Antidiabetic Drugs. 33. Mechanisms of hypoglycemic activity of ganoderan-B - a glycan of Ganoderma lucidum fruit bodies. Planta Medica, 55 (5): 423-428. [ Links ]
19. Hirotani M, Asaka I, Ino C, Furuya T, Shiro M. 1987. Ganoderic acid derivatives and ergosta-4,7,22-triene-3,6-dione from Ganoderma lucidum. Phytochemistry, 26: 2797. [ Links ]
20. Hirotani M, Furuya T, Shiro M. 1985. A ganoderic acid derivative, a highly oxygenated lanostane-type triterpenoid from Ganoderma lucidum. Phytochemistry, 24: 2055-2061. [ Links ]
21. Hönes I, Pospischil A, Berg H. 1998. Electrostimulation of proliferation of the denitrifying bacterium Pseudomonas stutzeri. Bioelectrochemistry and Bioenergetics, 44: 275-277. [ Links ]
22. Huie CW, Di X. 2004. Chromatographic and electrophoretic methods for Lingzhi pharmacologically active components. Journal of Chromatography B, 812: 241-257. [ Links ]
23. Hülsheger H, Potel J, Niemann EG. 1981. Killing of bacteria with electric pulses of high field strength. Radiation and Environmental Biophysics, 20: 53-65. [ Links ]
24. Jitsufuchi Y, Yamamoto M. 1987. Research for improvement of Lentinula edodes cultivation: application of electric stimulation for mushroom cultivation. Representative Kyushu Electric Company, # 87004. [ Links ]
25. Kerns G, Bauer E, Berg H. 1993. Electrostimulation of cellulase fermentation by pulsatile electromagnetically induced currents. Bioelectrochemistry and Bioenergetics, 32: 89-94. [ Links ]
26. Ko HH, Hung CF, Wang JP, Lin CN. 2008. Antiinflammatory triterpenoids and steroids from Ganoderma lucidum and G. tsugae. Phytochemistry, 69: 234-239. [ Links ]
27. Lin SB, Li CH, Lee SS, Kan LS. 2003. Triterpene-enriched extracts from Ganoderma lucidum inhibit growth of hepatoma cells via suppressing protein kinase C, activating mitogen-activated protein kinases and G2-phase cell cycle arrest. Life Sciences, 72: 2381-2390. [ Links ]
28. Lin ZB. 2005. Cellular and molecular mechanisms of immuno-modulation by Ganoderma lucidum. Journal of Pharmacological Sciences, 99: 144-153. [ Links ]
29. Lin ZB, Cao Q Z. 2004. The effect of Ganoderma lucidum polysaccharides peptide on invasion of human lung carcinoma cells in vitro. Clinical and Experimental Pharmacology and Physiology, 31: A233-A233. [ Links ]
30. Liu J, Shimizu K, Konishi F, Noda K, Kumamoto S, Kurashiki K, Kondo R. 2007. Anti-androgenic activities of the triterpenoids fraction of Ganoderma lucidum. Food Chemistry, 100: 1691-1696. [ Links ]
31. Liu YH, Tsai CF, Kao MC, Lai YL, Tsai JJ. 2003. Effectiveness of Dp2 nasal therapy for Dp2- induced airway inflammation in mice: using oral Ganoderma lucidum as an immunomodulator. Journal of Microbiology, Immunology and Infection, 36: 236-42. [ Links ]
32. Mazurek B, Lubicki P, Staroniewicz Z. 1995. Effect of short Hv pulses on Bacteria and Fungi. Ieee Transactions on Dielectrics and Electrical Insulation, 2: 418-425. [ Links ]
33. Min BS, Nakamura N, Miyashiro H, Bae KW, Hattori M. 1998. Triterpenes from the spores of Ganoderma lucidum and their inhibitory activity against HIV-1 protease. Chemical and Pharmaceutical Bulletin, 46: 1607-1612. [ Links ]
34. Murr LE. 1966. Physiological stimulation of plants using delayed and regulated electric field environments. International Journal of Biometeorology, 10: 147-153. [ Links ]
35. Nakanishi K, Tokuda H, Soga T, Yoshinaga T, Takeda M. 1998. Effect of electric current on growth and alcohol production by yeast cells. Journal of Fermentation and Bioengineering, 85: 250-253. [ Links ]
36. Ohga S, Cho N, Li Y, Royse D. 2004. Utilization of pulsed power to stimulate fructification of edible mushroom. Mushroom Science Biotechnology, 16: 343-351. [ Links ]
37. Ohga S, Iida S. 2001a. Effect of electric impulse on fruit body production of Lentinula edobes in the sawdust-based substrate. Mushroom Science Biotechnology, 9: 7-12. [ Links ]
38. Ohga S, Iida S. 2001b. Effect of electric impulse on sporocarp formation of ectomycorrhizal fungus Laccaria laccata in Japanese red pine plantation. Journal of Forest Research, 6: 37-41. [ Links ]
39. Ohshima T, Tamura T, Sato M. 2007. Influence of pulsed electric field on various enzyme activities. Journal of Electrostatics, 65: 156-161. [ Links ]
40. Patocka J. 1999. Anti-inflammatory triterpenoids from mysterious mushroom Ganoderma lucidum and their potential possibility in modern medicine. Acta Medica (Hradec Kralove), 42: 123-125. [ Links ]
41. Pohl H, Todd G. 1981. Electroculture for crop enhancement by air anions. International Journal of Biometeorology, 25: 309-321. [ Links ]
42. Shigemitsu T. 1999. Biological and agricultural studies on application of discharge plasma and electromagnetic fields 3. Effects of electrical fields, air ion and corona discharge on plants. Journal of Plasma and Fusion Research Series, 75: 659-665. [ Links ]
43. Song YS, Kim SH, Sa JH, Jin C, Lim CJ, Park E H. 2004. Anti-angiogenic and inhibitory activity on inducible nitric oxide production of the mushroom Ganoderma lucidum. Journal of Ethnopharmacology, 90: 17-20. [ Links ]
44. Stanley G, Harvey K, Slivova V, Jiang JH, Sliva D. 2005. Ganoderma lucidum suppresses angiogenesis through the inhibition of secretion of VEGF and TGF-beta 1 from prostate cancer cells. Biochemical and Biophysical Research Communications, 330: 46-52. [ Links ]
45. Takaki K, Yamazaki N, Mukaigawa S, Fujiwara T, Kofujita H. 2009. Improvement of edible mushroom yield by electric stimulations. Journal of Plasma and Fusion Research Series, 8: 556-559. [ Links ]
46. Tang W, Gu T, Zhong J J. 2006. Separation of targeted ganoderic acids from Ganoderma lucidum by reversed phase liquid chromatography with ultraviolet and mass spectrometry detections. Biochemical Engineering Journal, 32: 205-210. [ Links ]
47. Tang Y-J, Zhang W, Zhong JJ. 2009. Performance analyses of a pH-shift and DOT-shift integrated fed-batch fermentation process for the production of ganoderic acid and Ganoderma polysaccharides by medicinal mushroom Ganoderma lucidum. Bioresource Technology, 100: 1852-1859. [ Links ]
48. Tang YJ, Zhong JJ. 2002. Fed-batch fermentation of Ganoderma lucidum for hyperproduction of polysaccharide and ganoderic acid. Enzyme and Microbial Technology, 31: 20-28. [ Links ]
49. Tsong TY. 1990. Electrical modulation of membrane proteins: enforced conformational oscillations and biological energy and signal transductions. Annual Review of Biophysics and Biophysical Chemistry, 19: 83-106. [ Links ]
50. R, Mitchell DA, Sassaki GL, Amazonas MALdA, Berovic M. 2003. Current techniques for the cultivation of Ganoderma lucidum for the production of biomass, ganoderic acid and polysaccharides. Food Technology and Biotechnology, 41: 371-382. [ Links ]
51. Yang FC, Hsieh C, Chen HM. 2003. Use of stillage grain from a rice-spirit distillery in the solid state fermentation of Ganoderma lucidum. Process Biochemistry, 39: 21-26. [ Links ]
52. Yang F-C, Yang MJ, Cheng SH. 2009. A novel method to enhance the mycelia production of Ganoderma lucidum in submerged cultures by polymer additives and agitation strategies. Journal of the Taiwan Institute of Chemical Engineers, 40: 148-154. [ Links ]
53. Yang Q, Wang S, Xie Y, Sun J, Wang J. 2010. HPLC analysis of Ganoderma lucidum polysaccharides and its effect on antioxidant enzymes activity and Bax, Bcl-2 expression. International Journal of Biological Macromolecules, 46 (2): 167-172. [ Links ]
54. Zapata PA. 2007. Evaluación y desarrollo de un medio de cultivo para la producción de biomasa micelial del hongo medicinal Ganoderma lucidum bajo cultivo sumergido. Medellín (Colombia): Facultad de Ciencias Exactas y Naturales, Instituto de Biología. Universidad de Antioquia. [ Links ]
55. Zhang GL, Wang YH, Ni W, Teng HL, Lin ZB. 2002. Hepatoprotective role of Ganoderma lucidum polysaccharide against BCG-induced immune liver injury in mice. World Journal of Gastroenterology, 8: 728-733. [ Links ]
Recibido: octubre 2009;
aceptado: abril 2010.