Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
Ingeniería y Ciencia
versão impressa ISSN 1794-9165
ing.cienc. vol.10 no.20 Medellín jul./dez. 2014
ARTÍCULO ORIGINAL
Densificación de cerámicas de PZN-10PT a partir de polvos sintetizados por el método de reacción por combustión
Densification of PZN-10PT ceramics from powders obtained by the combustion reaction synthesis
Raigoza C. F. V. 1, Eiras J.A. 2, Ruth H. G. A. Kiminami 3 y Garcia D. 4
1 Doctorado en Ciencia e Ingeniería de Materiales, gure@unicauca.edu.co, Universidad del Cauca, Popayán, Colombia.
2 Doctor en Metalurgia Física, eiras@df.ufscar.br, Universidade Federal de São Carlos, São Carlos, Brasil.
3 Doctora en Ingenieria de Materiales, ruth@power.ufscar.br, Universidade Federal de São Carlos, São Carlos, Brasil
4 Doctora en Física, ducinei@df.ufscar.br, Universidade Federal de São Carlos, São Carlos, Brasil.
Recepción: 25-03-2014, Aceptación: 16-05-2014 Disponible en línea: 01-07-2014
MSC: 74E15, 74E40, 74N15, PACS: 80.81
Resumen
Monocristales de ((1 - x)Pb(Zn1/3Nb2/3)O3-xPbTiO3-(1 - x)PZN-xPT) con estructura perovskita, muestran excelentes propiedades dieléctricas, ópticas y electrostrictivas en composiciones cerca a la frontera de fase morfotrópica (FFM), x 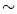 0;09. La preparación de cerámicas con composiciones cercanas a la FFM por métodos convencionales, conduce a cerámicas con estructura pirocloro. En este trabajo, polvos de ((1-x)Pb(Zn1/3Nb2/3)O3- xPbTiO3-PZN-xPT) con x = 0;10 fueron sintetizados por el método de reacción por combustión. Como combustibles fueron usados: CO(NH2)2, C2H5NO2, CO(NH2)2/C2H5NO2 y C4H16N6O2. El resultado indica que el mayor porcentaje de fase perovskita (
0;09. La preparación de cerámicas con composiciones cercanas a la FFM por métodos convencionales, conduce a cerámicas con estructura pirocloro. En este trabajo, polvos de ((1-x)Pb(Zn1/3Nb2/3)O3- xPbTiO3-PZN-xPT) con x = 0;10 fueron sintetizados por el método de reacción por combustión. Como combustibles fueron usados: CO(NH2)2, C2H5NO2, CO(NH2)2/C2H5NO2 y C4H16N6O2. El resultado indica que el mayor porcentaje de fase perovskita (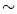 70 %) fue obtenido usando CO(NH2)2= C2H5NO2 (razón 50/50). Esta fase es mantenida al sinterizar la muestra a 1000 ° C en atmósfera de nitrógeno.
70 %) fue obtenido usando CO(NH2)2= C2H5NO2 (razón 50/50). Esta fase es mantenida al sinterizar la muestra a 1000 ° C en atmósfera de nitrógeno.
Palabras clave: PZN-PT; perovskita; auto-combustión; dilatometría.
Abstract
((1-x)Pb(Zn1/3Nb2/3)O3-xPbTiO3-(1-x)PZN-xPT) single crystals with perovskite structure near to the morphotropic phase boundary (MPB), x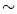 0; 09, exhibit unusual large dielectric and piezoelectric constants. Preparation of PZN-PT ceramics with composition near to the MPB using conventional methods leads to ceramics with pyrochlore structure. In this paper, ((1 - x)Pb(Zn1/3Nb2/3)O3-xPbTiO3-PZN-xPT) powders with x = 0; 10 were synthetized by the combustion reaction method. CO(NH2)2, C2H5NO2, CO(NH2)2/C2H5NO2 y C4H16N6O2 were used as fuels. Results show that a maximum of 70% of perovskite phase was obtained using CO(NH2)2= C2H5NO2 (in relation 50/50). The afore mentioned phase is preserved when sintering the sample at 1000 ° C, during 4h on nitrogen atmosphere.
0; 09, exhibit unusual large dielectric and piezoelectric constants. Preparation of PZN-PT ceramics with composition near to the MPB using conventional methods leads to ceramics with pyrochlore structure. In this paper, ((1 - x)Pb(Zn1/3Nb2/3)O3-xPbTiO3-PZN-xPT) powders with x = 0; 10 were synthetized by the combustion reaction method. CO(NH2)2, C2H5NO2, CO(NH2)2/C2H5NO2 y C4H16N6O2 were used as fuels. Results show that a maximum of 70% of perovskite phase was obtained using CO(NH2)2= C2H5NO2 (in relation 50/50). The afore mentioned phase is preserved when sintering the sample at 1000 ° C, during 4h on nitrogen atmosphere.
Key words: PZN-PT; perovskite phase; combustion synthesis; dilatometry.
1 Introducción
La solución sólida entre el Pb(Zn1/3Nb2/3)O3 (PZN) y el PbTiO3 (PT) tiene una frontera de fase morfotrópica (FFM) a 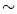 10% molar de PT [1]. Monocristales con composición cerca a la FFM presentan extremadamente grandes valores en su constante dieléctrica y en sus coeficientes piezoeléctricos [2]. Sin embargo, ha sido reportado que cristales de 0, 90PZN-0, 10PT (PZN-10PT) son termodinámicamente inestables sobre un amplio rango de temperaturas (600-1400°C) [3]. Wakiya y colaboradores [4] estudiaron la estabilidad térmica del PZN para una atmósfera saturada en vapor de PbO y concluyeron que es imposible la síntesis de cerámicas de PZN en un rango de temperatura entre 900°C - 1200°C, ellos también muestran que en este rango de temperatura la fase perovskita se descompone en las fases pirocloro, ZnO y PbO. La presencia de fases indeseables, tal como la pirocloro, aun en pequeñas cantidades genera el detrimento de las propiedades dieléctricas y piezoeléctricas. Este trabajo presenta un análisis de la influencia del combustible en la síntesis de polvos del sistema ferroeléctrico PZN-10PT por reacción de combustión. El proceso está basado en el principio que, una vez iniciada la reacción por una fuente externa, ocurre una reacción exotérmica haciendo la reacción autosostenible generando el producto final en un corto periodo de tiempo [5]. Algunos autores también señalan que es necesario incorporar una ayuda externa para favorecer la reacción de combustión [6],[7]. Para lograr esto, fue incorporado nitrato de amonio (NH4NO3) como un oxidante adicional, este aditivo proporciona un aporte extra de NO− 3 , haciendo que el proceso de descomposición sea altamente exotérmico y genere sólo productos gaseosos [8]. La adición de NH4NO3 aumenta los gases de combustión, cuyo efecto es el de ampliar la estructura espumosa más allá de la obtenida cuando se utilizan sólo los precursores metálicos y eventualmente aumenta el área superficial. La adición de NH4NO3 a la mezcla ocasiona que la síntesis de combustión termine rápidamente y a menor temperatura [8]. Para este propósito fueron usados cuatro tipos de combustibles: urea (CO(NH2)2), glicina (C2H5NO2), mezcla de CO(NH2)2/C2H5NO2 (razón 50/50) y tetraformal triazina (C4H16N6O2). Posteriormente fueron compactadas muestras en forma de paralelepípedo a partir de polvos sintetizados con la mezcla de urea/glicina, a estas muestras les fue realizado un análisis dilatométrico en aire y nitrógeno.
10% molar de PT [1]. Monocristales con composición cerca a la FFM presentan extremadamente grandes valores en su constante dieléctrica y en sus coeficientes piezoeléctricos [2]. Sin embargo, ha sido reportado que cristales de 0, 90PZN-0, 10PT (PZN-10PT) son termodinámicamente inestables sobre un amplio rango de temperaturas (600-1400°C) [3]. Wakiya y colaboradores [4] estudiaron la estabilidad térmica del PZN para una atmósfera saturada en vapor de PbO y concluyeron que es imposible la síntesis de cerámicas de PZN en un rango de temperatura entre 900°C - 1200°C, ellos también muestran que en este rango de temperatura la fase perovskita se descompone en las fases pirocloro, ZnO y PbO. La presencia de fases indeseables, tal como la pirocloro, aun en pequeñas cantidades genera el detrimento de las propiedades dieléctricas y piezoeléctricas. Este trabajo presenta un análisis de la influencia del combustible en la síntesis de polvos del sistema ferroeléctrico PZN-10PT por reacción de combustión. El proceso está basado en el principio que, una vez iniciada la reacción por una fuente externa, ocurre una reacción exotérmica haciendo la reacción autosostenible generando el producto final en un corto periodo de tiempo [5]. Algunos autores también señalan que es necesario incorporar una ayuda externa para favorecer la reacción de combustión [6],[7]. Para lograr esto, fue incorporado nitrato de amonio (NH4NO3) como un oxidante adicional, este aditivo proporciona un aporte extra de NO− 3 , haciendo que el proceso de descomposición sea altamente exotérmico y genere sólo productos gaseosos [8]. La adición de NH4NO3 aumenta los gases de combustión, cuyo efecto es el de ampliar la estructura espumosa más allá de la obtenida cuando se utilizan sólo los precursores metálicos y eventualmente aumenta el área superficial. La adición de NH4NO3 a la mezcla ocasiona que la síntesis de combustión termine rápidamente y a menor temperatura [8]. Para este propósito fueron usados cuatro tipos de combustibles: urea (CO(NH2)2), glicina (C2H5NO2), mezcla de CO(NH2)2/C2H5NO2 (razón 50/50) y tetraformal triazina (C4H16N6O2). Posteriormente fueron compactadas muestras en forma de paralelepípedo a partir de polvos sintetizados con la mezcla de urea/glicina, a estas muestras les fue realizado un análisis dilatométrico en aire y nitrógeno.
2 Materiales y métodos
Como fuente de los cationes plomo, zinc, niobio y titanio, fueron usados Pb(NO3)2 · 9H2O (Merck, pureza 99.5%), (CH3COO)2· Zn.2H2O (Merck, pureza 99.5%), NH4H2· [NbO(C2O4)3]·3H2O (CBMM, 99%), C8H20O4Ti (Merck, pureza 95%). El NH4NO3 fue adicionado en una relación 1 : 5 molar, precursores : nitrato de amonio. La cantidad a utilizar de nitrato de plomo, acetato de zinc, complejo amoniacal de niobio y tetraetilortotitanato fue calculada a partir de la estequiometria de la composición 0, 90PZN-0, 10PT. La cantidad de combustible necesaria fue calculada con base en sus valencias totales de oxidación y reducción (C=+4, H=+1, Pb=+2, Zn=+2, Nb=+5, Ti=+4, O=-2, N=0), las cuales fueron utilizadas como coeficientes en el balance estequiométrico, φ = 1, en la Ecuación (1) [9]:
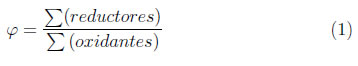
Para evaluar la influencia del combustible en la formación de la fase deseada, se utilizaron cuatro tipos de combustible diferentes: urea (CH4N2O), glicina (C2H5NO2), mezcla de urea y glicina (50/50) y TFTA (C4H16N6O2). El TFTA fue preparado por la adición, gota a gota, de 4 moles de formaldeído en 3 moles de hidrazina, manteniendo una temperatura inferior a 5°C. Esa adición genera una reacción exotérmica, donde se obtiene una masa viscosa de color blanco, la cual fue filtrada, lavada con agua destilada y, posteriormente, sometida a secado en una estufa de vacío, a  60°C, por dos días. Inicialmente, los precursores de plomo y zinc fueron disueltos separadamente en una cantidad mínima de agua y los precursores de titanio y niobio fueron disueltos en una solución 1M de ácido nítrico hasta alcanzar su completa disolución. Las soluciones que contienen los precursores fueron colocadas en un crisol de sílica vítrea, y posteriormente fue adicionado el combustible; este proceso se llevó a cabo en continua agitación. La solución se mantiene a una temperatura de
60°C, por dos días. Inicialmente, los precursores de plomo y zinc fueron disueltos separadamente en una cantidad mínima de agua y los precursores de titanio y niobio fueron disueltos en una solución 1M de ácido nítrico hasta alcanzar su completa disolución. Las soluciones que contienen los precursores fueron colocadas en un crisol de sílica vítrea, y posteriormente fue adicionado el combustible; este proceso se llevó a cabo en continua agitación. La solución se mantiene a una temperatura de  100°C en una estufa marca Quimis, por el período de tiempo que permita la eliminación considerable del líquido presente; posteriormente el crisol se introduce en una mufla (marca EDG, modelo 3000) pre-calentada a una temperatura de
100°C en una estufa marca Quimis, por el período de tiempo que permita la eliminación considerable del líquido presente; posteriormente el crisol se introduce en una mufla (marca EDG, modelo 3000) pre-calentada a una temperatura de  400°C; tal disposición imposibilitó la medida de la temperatura que alcanza la mezcla cuando se genera la reacción. El resultado fue el desarrollo de una combustión simultánea, cuando el sistema alcanzó la temperatura de ignición; este procedimiento fue usado para los cuatro combustibles utilizados. Los polvos con mayor porcentaje de fase perovskita fueron conformados en muestras en forma de cilindro de 10 mm de diámetro, para esto el polvo se mezcló con 2% en peso de polivinil butiral (PVB) diluido en acetona, para garantizar la forma de la muestra el polvo más el ligante fueron sometidos a prensado uniaxial, aplicando una fuerza de 4 toneladas por un tiempo de 5 minutos; posteriormente las muestras fueron sometidas a prensado isostático en frio, aplicando una fuerza de 25 toneladas durante 20 minutos, con el fin de obtener un compacto en verde homogéneo. De estas muestras se obtuvieron paralelepípedos regulares a los que se les eliminó el ligante por medio de tratamiento térmico a una temperatura de 500°C por 3 horas, realizado en una mufla marca EDG, modelo 3000. Los paralelepípedos fueron sometidos a análisis dilatométrico en atmósferas de aire y nitrógeno. Los polvos y las cerámicas fueron caracterizados por difracción de rayos X (DRX) usando un difractómetro Siemens 5100, radiación CuK, un paso de 0.02° 2θ/min, en un rango para 2θ de 20-60°; una forma aproximada de determinar la cantidad relativa de la fase perovskita utilizando los patrones de difracción de rayos-X es mediante el uso de la expresión (2) [3]:
400°C; tal disposición imposibilitó la medida de la temperatura que alcanza la mezcla cuando se genera la reacción. El resultado fue el desarrollo de una combustión simultánea, cuando el sistema alcanzó la temperatura de ignición; este procedimiento fue usado para los cuatro combustibles utilizados. Los polvos con mayor porcentaje de fase perovskita fueron conformados en muestras en forma de cilindro de 10 mm de diámetro, para esto el polvo se mezcló con 2% en peso de polivinil butiral (PVB) diluido en acetona, para garantizar la forma de la muestra el polvo más el ligante fueron sometidos a prensado uniaxial, aplicando una fuerza de 4 toneladas por un tiempo de 5 minutos; posteriormente las muestras fueron sometidas a prensado isostático en frio, aplicando una fuerza de 25 toneladas durante 20 minutos, con el fin de obtener un compacto en verde homogéneo. De estas muestras se obtuvieron paralelepípedos regulares a los que se les eliminó el ligante por medio de tratamiento térmico a una temperatura de 500°C por 3 horas, realizado en una mufla marca EDG, modelo 3000. Los paralelepípedos fueron sometidos a análisis dilatométrico en atmósferas de aire y nitrógeno. Los polvos y las cerámicas fueron caracterizados por difracción de rayos X (DRX) usando un difractómetro Siemens 5100, radiación CuK, un paso de 0.02° 2θ/min, en un rango para 2θ de 20-60°; una forma aproximada de determinar la cantidad relativa de la fase perovskita utilizando los patrones de difracción de rayos-X es mediante el uso de la expresión (2) [3]:
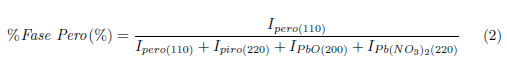
donde Ipero, Ipiro, IPbO and IPb(NO3)2 representan las intensidades de los picos mayores de las fases perovskita (110), pirocloro (220), óxido de plomo (200) y nitrato de plomo (220), respectivamente. Polvos y cerámicas fueron caracterizados por microscopia electrónica de barrido, usando un microscopio Philips XL30-FEG, equipado con microanálisis por espectroscopia de energía dispersiva (EDS).
3 Resultados y discusión
En la Figura 1, son presentados los perfiles de difracción de rayos X de los polvos obtenidos directamente del proceso de reacción por combustión, utilizando los combustibles: urea, glicina, mezcla de urea/glicina (50/50) y TFTA. Se puede observar que la urea (Figura 1a) es capaz de generar sólo la energía que se requiere para sintetizar la fase pirocloro, sin embargo se observa una cantidad (30%) del nitrato de plomo utilizado como precursor, cuando se usa glicina como combustible (Figura 1b) se observan picos de las fases pirocloro (48%), PbO (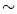 21%) y perovskita (
21%) y perovskita (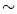 31%). Cuando la mezcla de glicina/urea, en razón 50/50, es usada como combustible (Figura 3c), se encuentra una concentración de la fase ferroeléctrica de
31%). Cuando la mezcla de glicina/urea, en razón 50/50, es usada como combustible (Figura 3c), se encuentra una concentración de la fase ferroeléctrica de 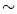 69% y como fases no deseadas se encuentran las fases pirocloro y óxido de plomo. Resultado nuevo, como también sorprendente, por la cantidad de fase perovskita obtenida directamente del proceso de combustión, sin ningún tratamiento térmico posterior. Con el uso de TFTA como combustible (Figura 1d), se obtiene una concentración de
69% y como fases no deseadas se encuentran las fases pirocloro y óxido de plomo. Resultado nuevo, como también sorprendente, por la cantidad de fase perovskita obtenida directamente del proceso de combustión, sin ningún tratamiento térmico posterior. Con el uso de TFTA como combustible (Figura 1d), se obtiene una concentración de 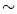 63% de la fase perovskita, como fases secundarias se observan la fase pirocloro y óxido de plomo. Un resultado también bueno y nuevo.
63% de la fase perovskita, como fases secundarias se observan la fase pirocloro y óxido de plomo. Un resultado también bueno y nuevo.
Las micrografías de los polvos cerámicos obtenidos usando la mezcla de urea/glicina y TFTA son presentados en las Figuras 2a y 2b respectivamente. Se puede observar en los dos casos que las partículas son nanométricas y hay presencia de aglomerados. Se confirma así, por tanto, que la combinación de glicina y urea, por lo menos en la razón 50/50 (para la mezcla con 200 mL de agua, y con nitrato de amonio como aditivo), al contrario de los resultados mediocres que cada combustible proporciona separadamente, es adecuada para la síntesis por combustión de PZN-PT, con altas concentraciones de fase perovskita, mayores aun que cuando se utiliza el combustible TFTA. Se observa así, que el conjunto de precursores utilizados, posibilitó resultados inéditos para la síntesis por combustión de polvos de PZN-PT, en las condiciones evaluadas. Resultados (de la formación de fase perovskita con concentraciones de hasta  70%, sin tratamientos térmicos adicionales) hasta entonces no habían sido presentados en la literatura, aunque habían sido indicados como posibles por Sekar y colaboradores [6],[7].
70%, sin tratamientos térmicos adicionales) hasta entonces no habían sido presentados en la literatura, aunque habían sido indicados como posibles por Sekar y colaboradores [6],[7].

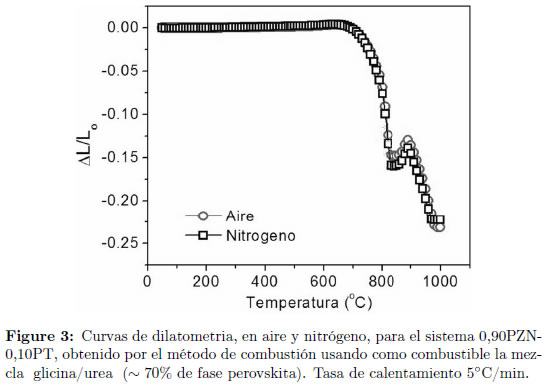
La densidad de las muestras en verde, obtenidas de los polvos sintetizados por el método de reacción por combustión usando una mezcla de glicina/urea (50/50) con  70% de concentración de fase perovskita fue de 4,33 g/cm3. A estas muestras se le realizaron estudios de dilatometria; en la Figura 3 se presentan las curvas resultado de este análisis para dos atmósferas: aire y nitrógeno, donde se observa que el comportamiento de la contracción lineal es similar para las dos atmósferas. En ambas curvas, vemos que, entre 700°C y 1000°C, el material se contrae cerca de 25%; entre
70% de concentración de fase perovskita fue de 4,33 g/cm3. A estas muestras se le realizaron estudios de dilatometria; en la Figura 3 se presentan las curvas resultado de este análisis para dos atmósferas: aire y nitrógeno, donde se observa que el comportamiento de la contracción lineal es similar para las dos atmósferas. En ambas curvas, vemos que, entre 700°C y 1000°C, el material se contrae cerca de 25%; entre  830°C y
830°C y  900°C, sin embargo, el material sufre un proceso de dilatación discreto. La densidad de la cerámica obtenida después del análisis dilatometrico fué de 7,01 g/cm3.
900°C, sin embargo, el material sufre un proceso de dilatación discreto. La densidad de la cerámica obtenida después del análisis dilatometrico fué de 7,01 g/cm3.
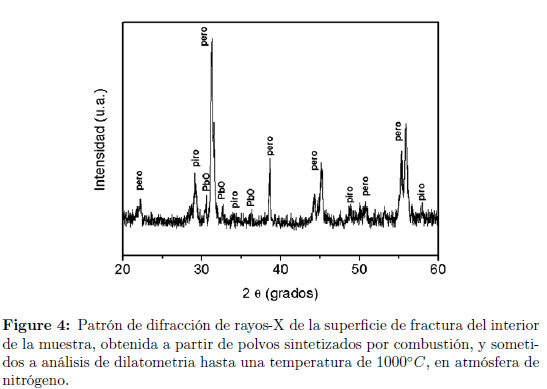
El aspecto de la muestra, después del análisis, fue de un cuerpo cerámico altamente poroso; esto se debe, probablemente, a la pérdida de masa durante el proceso de análisis. En el material utilizado para el estudio dilatométrico, en atmósfera de nitrógeno, se realizó análisis por difracción de rayos X y microscopia electrónica de barrido. El perfil de difracción de rayos X es presentado en la Figura 4, tal perfil corresponde al interior de la muestra, observándose que la fase perovskita es mayoritaria. Los porcentajes de las fases presentes D en la muestra (perovskita, pirocloro y óxido de plomo) son iguales a las del polvo de partida. Ese es un resultado inédito que indica lo promisorio que es el procesamiento de cerámicas de PZN-PT a partir de polvos sintetizados por reacción de combustión.
En la Figura 5, es presentada la microscopia electrónica de barrido realizada a la superficie de fractura del interior de la misma muestra, para diferentes aumentos. Como se puede observar, la muestra no es densa, lo que confirma el aspecto que presentó externamente. Con el análisis de EDS, se puede comprobar que la composición de los cristales es coherente con los resultados de difracción presentados en la Figura 4. La morfología de los granos de perovskita es de paralelepípedos regulares, y la mayoría tienen un tamaño inferior de 1µm.

4 Conclusiones
on el método de síntesis por combustión es posible obtener fase perovskita mayoritaria en polvos de PZN-PT. Eso se debe, probablemente, al hecho de que la síntesis es realizada en condiciones fuera del equilibrio (alta temperatura en un tiempo muy pequeño), lo que torna posible cristalizar la fase perovskita, que exige mayor energía térmica que la fase pirocloro. Sin embargo factores como el tipo de combustible, homogeneización de la mezcla, reactivos utilizados favorecen las condiciones en las cuales la reacción puede ser generada.
Agradecimientos
Los autores agradecemos a la Universidad del Cauca por el apoyo brindado durante el desarrollo de esta investigación y a la Companhia Brasileira de Metalurgia e Mineração (CBMM) por la donación del oxalato amoniacal de niobio utilizado en este estudio.
References
[1] D. E. Cox, B. Noheda, and G. Shirane, ''Universal phase diagram for high-piezoelectric perovskite systems,'' Applied Physics Letter, vol. 79, no. 3, pp. 400-402, 2001. [ Links ] [Online]. Available: http://dx.doi.org/10.1063/1.1384475 12
[2] K. Kuwata, M. Uchino, and S. Nomura, ''Dielectric and Piezoelectric Properties of 0.91Pb(Zn_3Nb_2O_3)-0.09PbTiO_3 Single Crystals,'' Japanese Journal of Applied Physics, vol. 21, no. 9, pp. 1298-1302, 1982. [ Links ] [Online]. Available: http://dx.doi.org/10.1143/JJAP.21.1298 12
[3] H. M. Jang, S. H. Oh, and J. H. Moon, ''Thermodynamic Stability and Mechanisms of Formation and Decomposition of Perovskite Pb(Zn_(1 /3)Nb_(2/3))0_3 Prepared by the PbO Flux Method,'' Journal of American Ceramic Society, vol. 75, no. 1, pp. 82-88, 1992. [ Links ] [Online]. Available: http://dx.doi.org/10.1111/j.1151-2916.1992.tb05446.x 12, 15
[4] N. Wakiya, ''Thermal stability of Pb(Zn_(1/3)Nb_(2/3))O_3 (PZN) and consideration of stabilization conditions of perovskite type compounds,'' Materials Research Bulletin, vol. 30, no. 9, pp. 1121-1131, 1995. [ Links ] [Online]. Available: http://www.sciencedirect.com/science/article/pii/0025540895001026 12
[5] R. Kiminami, ''Combustion and synthesis of nanopowder ceramic powders,'' Kona Powder and Particle, vol. 19, pp. 156-165, 2001. [ Links ] [Online]. Available: https://www.jstage.jst.go.jp/article/kona/19/0/19_2001019/_pdf 13
[6] M. A. Sekar, A. Halliyal, and K. C. Patil, ''Synthesis, characterization and properties of lead-based relaxor ferroelectrics,'' Journal of Materials Research, vol. 5, pp. 1210-1218, 1996. [ Links ] 13, 17
[7] M. A. Sekar and A. Halliyal, ''Low-temperature synthesis, characterization, and properties of lead-based ferroelectric niobates,'' Journal of American Ceramics Society, vol. 81, no. 2, pp. 380-388, 1998. [ Links ] 13, 17
[8] O. Burgos-Montes and E. al, ''Influence of combustion aids on suspension combustion synthesis of mullite powders,'' Journal of European Ceramic Society, vol. 26, no. 15, pp. 3365-3372, 2006. [ Links ] [Online]. Available: http://www.sciencedirect.com/science/article/pii/S0955221905007612 13
[9] S. R. Jain, K. C. Adiga, and V. R. Verneker, ''A new approach to thermochemical calculations of condensed fuel-oxidizer mixtures,'' Combustion and Flame, vol. 40, pp. 71-79, 1981. [ Links ] [Online]. Available: http://www.sciencedirect.com/science/article/pii/0010218081901115 14













